| Thema: Sauerstoff | Tags: Ozon, schweflige Säure, Elektrolyse | Klassenstufen: 7-8 | Versuchsart: LV |
Materialien
Hofmannscher Zersetzungsapparat, Reinplatinelektroden, Spannungsquelle, Kabelverbindungen, Luftballon, Kaliumiodid-Stärke-Papier
Chemikalien
5 M Schwefelsäure, Natriumthiosulfat
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Wasserstoff | H220 | -- |   |
| Schwefelsäure 10% | H319-H315 | P280-P302+P352-P305+P351+P338 |  |
| Kaliumiodid-Stärke-Papier | -- | -- | |
| Iod | H332-H312-H400 | -- |   |
| Natriumthiosulfatlösung 0,1 M | -- | -- |
Durchführung
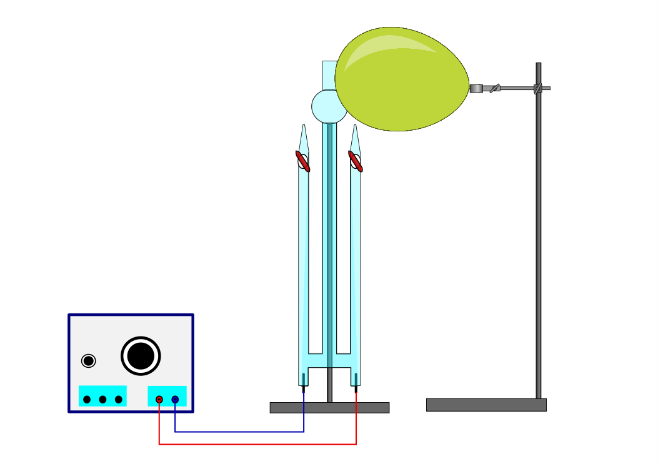
Der Hofmannsche Zersetzungsapparat mit Platinelektroden wird mit der 5 M Schwefelsäure befüllt. Eine Spannungsquelle wird über Kabelverbindungen mit den Elektroden verbunden. Zur Überprüfung der angelegten Spannung kann ein Voltmeter parallelgeschaltet werden. Die Hähne bleiben zunächst geschlossen. Der Ballon wird aufgepustet und über dem Hahn der Anode platziert. Die Spannungsquelle wird eingeschaltet und eine Spannung von 13 V wird angelegt. Ab einem entstandenen Volumen von 5 mL auf der Anodenseite kann der Hahn geöffnet werden und zunächst der gefüllte Ballon und anschließend das Kaliumiodid-Stärke-Papier mit Ozon bestrahlt werden.
Falls erwünscht, kann der entstandene Wasserstoff ebenfalls aufgefangen und nachgewiesen werden.
Beobachtung
Es ist eine Blasenbildung zu sehen. Auf der Seite der Kathode entsteht mehr Gas als auf der Seite der Anode. Der Ballon platzt nach Bestrahlen mit Anodengas, bei Kathodengas bleibt der Ballon unverändert. Das Kaliumiodid-Stärke-Papier verfärbt sich nach Bestrahlen mit Anodengas blau, bei Bestrahlen mit Kathodengas bleibt es unverändert.
Deutung
In dem Zersetzungsapparat werden Wasserstoff an der Kathode und Ozon an der Anode erzeugt:
Kathodenreaktion: 2 H3O+(aq) + 2 e- → H2 (g) + 2 H2O(l)
Anodenreaktion: 3 H2O(l) → O(ads) + 2 H3O+(aq) + 2 e-
O(ads) + O2 (ads) → O3 (g)
Der Wasserstoff wird durch die Knallgasprobe nachgewiesen:
2 H2 (g) + O2 (g) → 2 H2O(l)
Das Ozon greift die Gummihaut des Ballons an, wodurch dieser instabil wird und platzt. Das Kaliumiodid-Stärke-Papier färbt sich blau:
O3 (g) + 2 I-(s) + H2O(l) → O2 (g) + I2 (s) + 2 OH-(aq)
Entsorgung
Ballonreste und benutztes Kaliumiodid-Stärke-Papier werden in den Feststoffabfall gegeben. Ozon durch einen Trockenturm leiten, der mit Tonscherben gefüllt ist. Zur Zerstörung des Ozons sind diese Scherben mit 5 %iger Natronlauge oder anderen Reduktionsmitteln, wie z.B. Natriumdisulfitlösung, benetzt. Lösemittel und Olefine werden als halogenfreie oder halogenhaltige Lösemittelabfälle entsorgt.
Literatur
I. Parchmann, et al Behandlung des Themas Ozon im Chemieunterricht mit Hilfe anschaulicher Experimente, Plus Lucis, 5. Jahrgang, Nr. 1, 1997, S. 27-31
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.