| Thema: Salz und Salzbildung | Tags: Natrium, Chlorgas | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
Stativ mit Klammern, Zweihalsrundkolben, Schlauch, Tropftrichter, Standzylinder, Uhrglas, Reagenzglas mit Loch am unteren Ende, Becherglas, Spritzflasche mit Aqua dest., Gasbrenner, Dreifuß, Küchenpapier, Sand
Chemikalien
10 mL konzentrierte Salzsäure, 15 g Kaliumpermanganat, 0,2 g Natrium, ggf. Ethanol
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Salzsäure konz. | H314-H335 | -- |   |
| Kaliumpermanganat | H272-H302-H410 | -- |    |
| Natrium | H260-H314-EUH014 | -- |   |
| Chlor | H270-H331-H319-H335-H315-H400 | -- |     |
| Mangan(II)-chlorid | H302-H411 | P273-P301+P312 |   |
| Ethanol | 225‐319 | 210‐240‐305+351+338‐403+233 |   |
| Kaliumchlorid | -- | -- |
Durchführung
Achtung!: Es entsteht Chlorgas. Der Versuch muss unter einem Abzug durchgeführt werden.
Bei der Zugabe von erhitztem Natrium in das Chlor läuft eine exotherme Reaktion unter Freisetzung von Lichtenergie ab. Um SuS nicht zu blenden, sollten diese vorgewarnt werden, nicht direkt auf das Natrium zu sehen.
Experimentierhinweis: Es bietet sich an, diesen Versuch parallel zur Darstellung von Natriumchlorid aus Nichtmetall mit einer Lauge durch zu führen, da hier ebenfalls Chlorgas benötigt wird. Die angegebenen Mengen sind ausreichend, um beide Versuche durch zu führen.
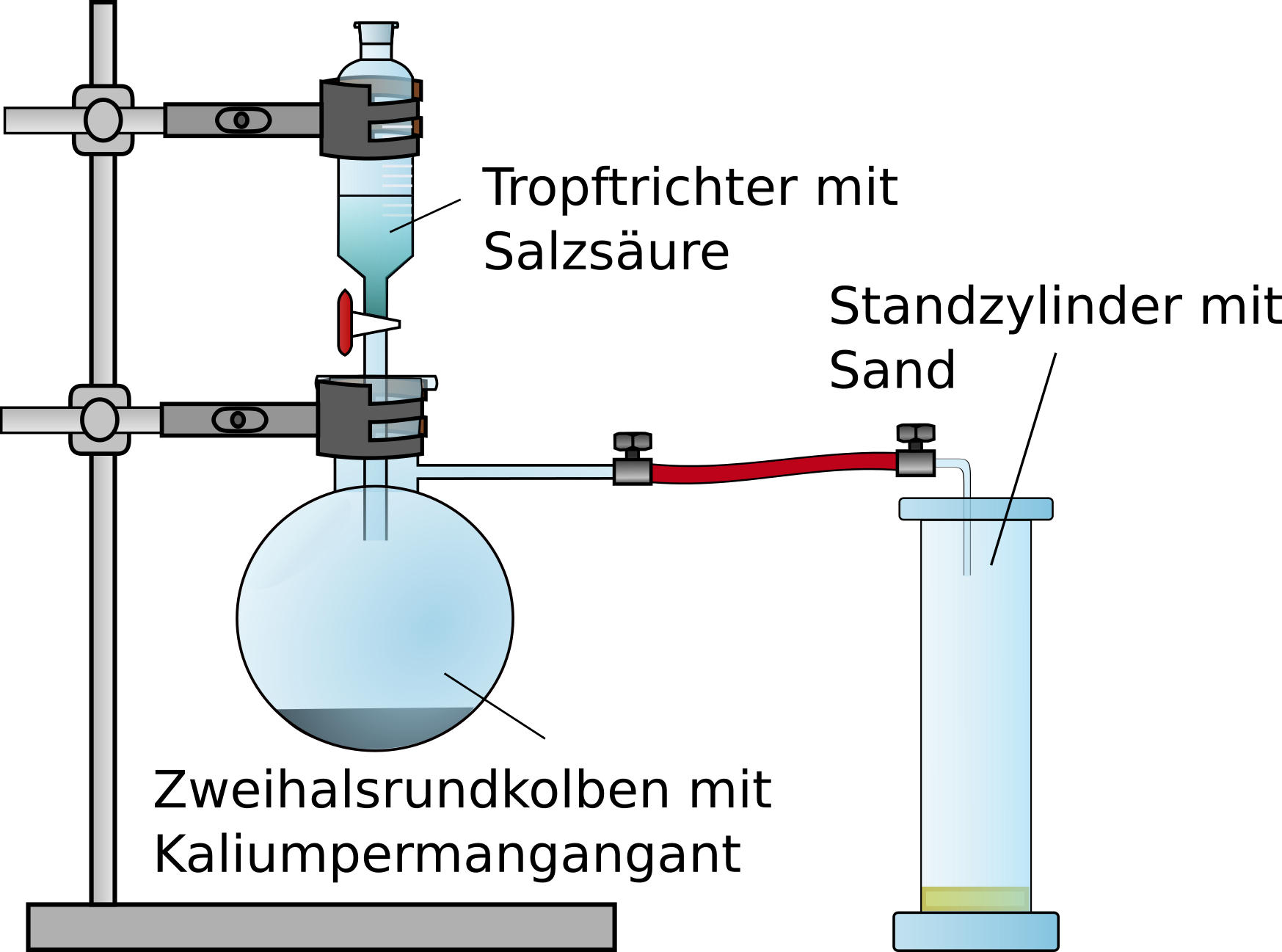
Die Apparatur wird wie in Abbildung 1 unter dem Abzug aufgebaut.
Die Salzsäure wird vorsichtig auf das Kaliumpermanganat getropft und das entstehende Chlorgas im Standzylinder aufgefangen und dieser mit einem Uhrglas abgedeckt.
Das Natrium wird aus dem Parrafinöl entnommen mit Küchenpapier getrocknet. Das trockene Natrium wird in ein Reagenzglas mit Loch gegeben und über einer Brennerflamme vorsichtig erhitzt. Sobald das Natrium geschmolzen ist und leicht brennt, wird es sofort in den Standzylinder gegeben. Um eine Verblendung zu vermeiden darf nicht direkt in das leuchtende Natrium gesehen werden.
Nach dem Abreagieren des Natriums wird die Apparatur abgegast, bis sämtliches Chlor aus dem Abzug gesogen wurde. Hat das Natrium nicht vollständig reagiert, wird es in Ethanol gegeben. (Am Reagenzglas ist ein weißer Niederschlag zu sehen. Dieser wird mit Auqa dest. in ein Becherglas gewaschen. Sollte das Wasser mit Sand verunreinigt sein, muss die Lösung durch Filterpapiere filtriert werden.)
Die Lösung wird auf einem Dreifuß über dem Gasbrenner eingedampft.
Beobachtung
Bei der Zugabe von Salzsäure zu Kaliumpermanganat läuft eine exotherme Reaktion ab und im Glas sammelt sich ein gelbes Gas. Das silberne Natriumstück wird beim Erhitzen kugelförmig und beginnt zu glühen. Beim Kontakt mit Chlorgas leuchtet es hell auf.
Beim Eindampfen fällt ein weißer Niederschlag aus, welcher sich beim Auswaschen löst und nach dem Eindampfen am Becherglas zurückbleibt.
Deutung
Beim Kontakt von Salzsäure mit Kaliumpermanganat läuft folgende Reaktion ab:
2 KMnO4 (s) + 16 HCl(aq) → 5 Cl2 (g) + 8 H2O(l) + 2 MnCl2 (s) + 2 KCl(s)
Das entstandene Chlorgas reagiert mit dem Natrium zu Natriumchlorid und bildet einen weißen Niederschlag:
Cl2 (g) + 2 Na(l) → 2 NaCl(s)
Natriumchlorid löst sich beim Auswaschen in Wasser. Beim Eindampfen sinkt die Löslichkeit von Natriumchlorid und es fällt als kristalliner Feststoff aus.
Entsorgung
Nicht verbranntes Natrium wird mit Ethanol neutralisiert und in den Behälter für organische Lösungsmittel gegeben. Kaliumpermanagat wird mit den Rückständen im Zweihalsrundkolben in den Behälter für Schwermetalle entsorgt.
Natrium- und Chloridionen sollten im Anschluss nachgewiesen werden.
Es bietet sich hier an, die Nachweisreaktionen im Vorfeld sowohl mit Natrium als auch mit Salzsäure durchzuführen. Salzsäure ist negativ für Natriumionen, so wie Natrium negativ auf Chloridionen ist.
Zur Sicherheit kann dieser Versuch auch auf Video aufgenommen und vorgeführt werden, da Chlorgas sehr gefährlich ist. Es bildet bei Kontakt mit Wasser (in der Lunge) ätzende Salzsäure.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.