| Thema: Metalle und Nichtmetalle | Tags: Metall, Verformbarkeit, Glanz, Eigenschaften, Leitfähigkeit | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
Krokodilklemmen, Multimeter, Kabel, Schmirgelpapier, Batterie (9V), gleichartige Stücke unterschiedlicher Metalle sowie Nichtmetalle wie Kohle oder Glas zum Vergleich
Chemikalien
Zink, Eisen, Kupfer (jeweils als Blech)
Durchführung
- Für die Untersuchung des metallischen Glanzes werden einige schmutzige oder angelaufene Metallstücke (Zinkblech, Kupferblech, Eisenblech…) mit feinem Schmirgelpapier geputzt. Man beachte die Farbveränderung der Oberflächen.
- Zur Prüfung der Verformbarkeit werden die gleichartigen Metallstücke mit den Händen gebogen. Zum Vergleich wird versucht, einen Kohle- und Glasstab zu biegen.
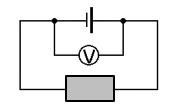
- Die elektrische Leitfähigkeit wird durch Einbringen der Testobjekte in einen Stromkreis mit parallel geschaltetem Multimeter zur Spannungsmessung geprüft (siehe Abb. 1)
Beobachtung
- Alle Metallstücke zeigen einen metallischen Glanz, der nach Lagerung an der Luft wieder verschwindet.
- Alle Metallstücke sind verformbar. Besonders leicht verformbar sind Zinn, Kupfer und Zink. Eisen lässt sich schwerer verformen. Glas- und Kohlenstoffstäbe lassen sich nicht verformen, sie zerspringen.
- Alle Metalle zeigen eine sehr gute Stromleitfähigkeit. Besonders gut leitfähig sind Kupfer und Zinn. Der Kohlestab sowie der Glasstab zeigen keine Leitfähigkeit für Strom.
Deutung
- Freie Elektronen können Licht aller Wellenlängen absorbieren. Deshalb erscheinen die Metalle undurchsichtig. Der metallische Glanz der meisten Metalle kommt durch die Reflexion von Licht verschiedener Wellenlängen zu Stande.
- Die gute Verformbarkeit der Metalle ist ebenfalls eine Folge der metallischen Bindung. Die Elektronen sind frei beweglich, gleiches gilt für die Atomrümpfe, die sich gegenseitig abstoßen und nur von den beweglichen Elektronen zusammengehalten werden. Wenn das Metallgitter verschoben wird, kann das Elektronengas die elektrostatische Abstoßung zwischen den positiven Ladungen kompensieren. Da der Kohle- und Glasstab keine solche metallische Bindung besitzen, sind sie auch nicht verformbar.
- Die Metall-Atome haben ihre Außenelektronen abgegeben, diese verbleiben im Metall und bilden ein so genanntes Elektronengas. Das bedeutet, dass die Elektronen im Metall frei beweglich sind. Das Elektronengas hält die positiv geladenen Atomrümpfe zusammen. Wenn keine elektrische Spannung an das Metall angelegt wird, bewegen sich die Elektronen mit hoher Geschwindigkeit in alle möglichen Richtungen durch das Metall. Legt man eine elektrische Spannung, wie z.B. durch eine Batterie an (Gleichstrom), so bewegen sich die Elektronen in Richtung des Pluspols. Der Stromkreis wird durch Einfügen eines Metallstückes geschlossen. Der Kohlestab stellt eine besondere Modifikation des Kohlenstoffs dar, die leitfähig ist. Der Glasstab hingegen besitzt keine Leitfähigkeit.
Literatur
Wiechoczek, Dagmar, http://www.chemieunterricht.de/dc2/kristalle/dc2kv22a.htm,29.07.2016 (Zuletzt abgerufen am 29.07.2016 um 19:35Uhr).
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.