| Thema: Saure und alkalische Haushaltssubstanzen III | Tags: Cola, Säure, Titration | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
250 mL Becherglas, Rührtisch mit Heizplatte, Rührfisch, Trichter, Siedesteine, Bürette, pH-Meter
Chemikalien
Cola, Natriumhydroxid-Lösung (0,1 M)
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Natronlauge 0,1 M | H314 | P280-P305+P351+P338-P310 |  |
Durchführung
150 mL Cola werden in ein Becherglas überführt. Zusätzlich werden Siedesteine in hinzugegeben. Die Cola wird über einem Gasbrenner für mindestens 5 Minuten erhitzt. Nachdem die Cola abgekühlt ist, werden 100 mL Cola in ein neues Becherglas gegeben und mit 0.1 M Natriumhydroxid-Lösung titriert. Die Zugabe erfolgt in 0,5 mL-Schritten. Nach jeder Zugabe der Lauge wird der pH-Wert dokumentiert. Nachdem keine wesentliche pH Änderung mehr sichtbar ist, werden die gewonnenen Daten auf Millimeterpapier aufgetragen.
Beobachtung
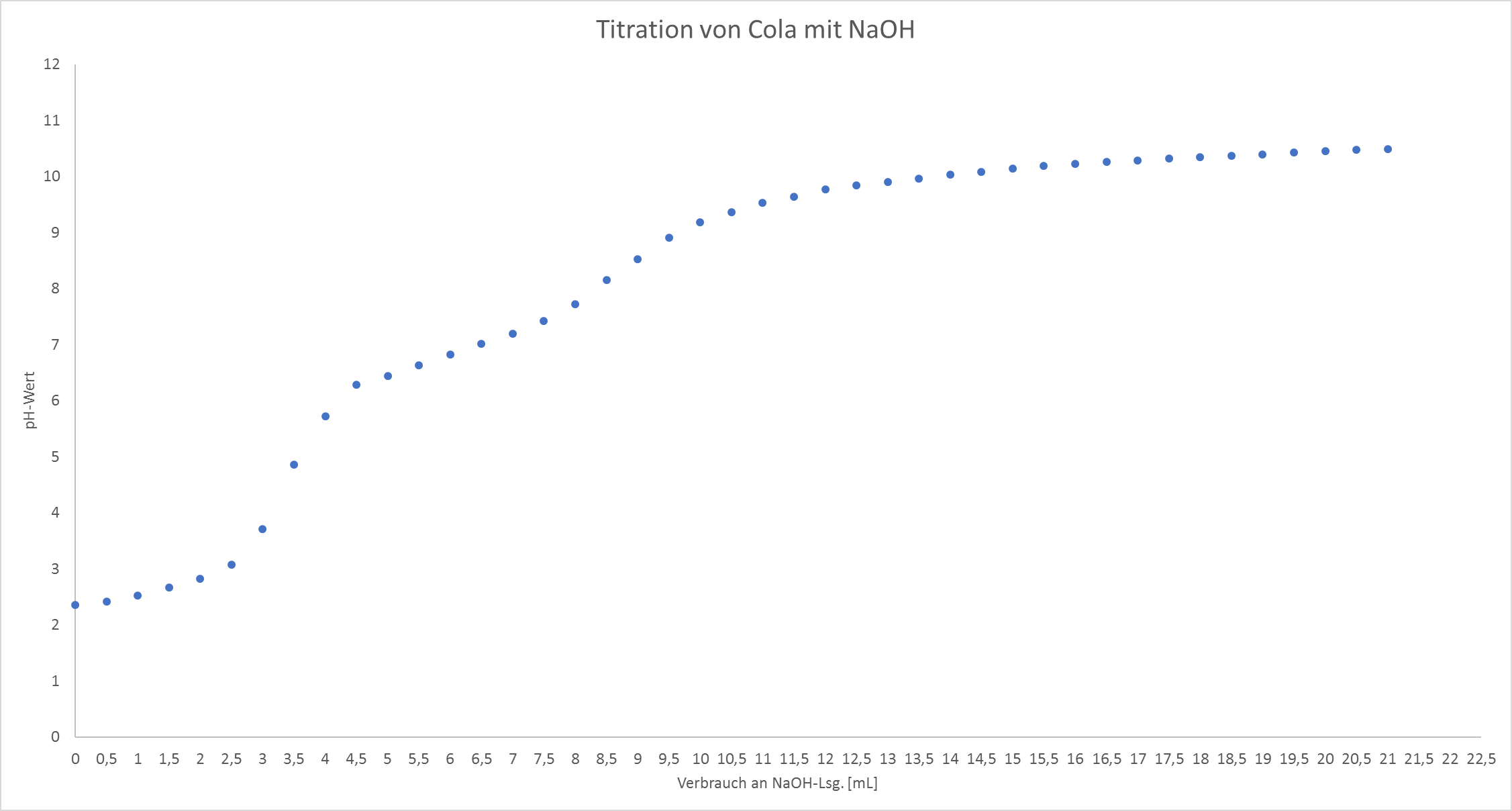
Zu Beginn der Titration liegt der pH-Wert bei 2,36. Der erste pH-Sprung ist nach einer Zugabe von 3,5 mL Natriumhydroxid-Lösung zu beobachten. Ein zweiter Sprung ist nach 8 mL Zugabe zu beobachten.
Tabelle 1: pH-Wert in Abhängigkeit der Zugabe von Natronlauge.
| Zugabe NaOH [mL] | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 4,5 | 5,0 | 5,5 | 6,0 | 6,5 | 7,0 |
| pH-Wert | 2,36 | 2,42 | 2,53 | 2,67 | 2,83 | 3,08 | 3,71 | 4,86 | 5,72 | 6,29 | 6,44 | 6,64 | 6,82 | 7,02 | 7,20 |
| Zugabe NaOH [mL] | 7,5 | 8,0 | 8,5 | 9,0 | 9,5 | 10,0 | 10,5 | 11,0 | 11,5 | 12,0 | 12,5 | 13,0 | 13,5 | 14,0 | |
| pH-Wert | 7,42 | 7,73 | 8,15 | 8,53 | 8,91 | 9,19 | 9,36 | 9,53 | 9,64 | 9,77 | 9,85 | 9,90 | 9,97 | 10,04 | |
| Zugabe NaOH [mL] | 14,5 | 15,0 | 15,5 | 16,0 | 16,5 | 17,0 | 17,5 | 18,0 | 18,5 | 19,0 | 19,5 | 20,0 | 20,5 | 21,0 | |
| pH-Wert | 10,09 | 10,14 | 10,19 | 10,23 | 10,26 | 10,29 | 10,32 | 10,35 | 10,37 | 10,40 | 10,43 | 10,45 | 10,48 | 10,49 | |
Deutung
Nachdem die Messwerte aufgetragen worden sind, ergibt sich eine Titrationskurve (vgl. Abb. 2), die sich wie folgt interpretieren lässt.
Bis zum 1. Äquivalenzpunkt:
Gleichung?
Zu Beginn der Titration liegen Phosphorsäure, Wasser, Dihydrogenphosphat und Oxonium-Ionen in Lösung vor. Nach Zugabe von Natronlauge, erhöht sich der pH-Wert langsam, da die Hydroxid-Ionen der Lauge mit den Oxonium-Ionen der Phosphorsäure zu Wasser reagieren. Der pH-Wert steigt nur langsam an, da die Gleichgewichts-Reaktion von Phosphorsäure und Dihydrogenphosphat den pH-Wert Anstieg puffern. Es handelt sich um ein Puffersystem, welches aus einer Säure (Phosphorsäure) und ihrer korrespondierenden Base (Dihydrogenphosphat) besteht.
Gleichung?
Die Henderson-Hasselbalch-Gleichung beschreibt den pH-Wert solcher Puffersysteme.
Gleichung?
Bis zum Äquivalenzpunkt liegt folgendes Gleichgewicht vor:
Gleichung?
Am Äquivalenzpunkt hat eine bestimmte Stoffmenge der Base (Natronlauge) die gleiche Stoffmenge der Säure (Phosphorsäure) neutralisiert. Zusätzlich lässt sich über den Äquivalenzpunkt der Halbäquivalenzpunkt bestimmen. Dieser liegt bei der Hälfte der bereits verbrauchten Natronlauge, in diesem Versuch also bei 1,7 mL zugegebener Natronlauge. Am Halbäquivalenzpunkt sind die Stoffmengen von Phosphorsäure und Dihydrogenphosphat gleich. Wird die Henderson-Hasselbalch-Gleichung betrachtet, fällt der Ausdruck [HA]/[A-] weg, da er 1 und der Logarithmus von Eins Null ergibt. Somit ist am Halbäquivalenzpunkt der pH-Wert gleich dem pKs-Wert, der pKs-Wert kann also aus der Auftragung abgelesen werden.
Gleichung?
Bis zum 2. Äquivalenzpunkt:
Gleichung?
Nach dem ersten Äquivalenzpunkt steigt der pH-Wert kurz steil an. Dies ist darin begründet, dass sich weitere Oxonium-Ionen nur schwer aus Dihydrogenphosphat lösen und diese die zugegebenen Hydroxid-Ionen nicht abpuffern können.
Gleichung?
Nach dem kurzen, steilen Anstieg des pH-Werts steigt dieser erneut nur schwach an, da ein neues Puffersystem aus Dihydrogenphosphat und Hydrogenphosphat entstanden ist. Bis zum zweiten Äquivalenzpunkt liegt folgendes Gleichgewicht vor:
Gleichung?
Am zweiten Äquivalenzpunkt hat eine bestimmte Stoffmenge der Base (Natronlauge), eine bestimmte Stoffmenge der Säure (Dihydrogenphosphat) neutralisiert. Der pH-Wert steigt leicht steil an, da die Hydroxid-Ionen nicht weiter neutralisiert werden, da sich das Oxonium-Ion aus dieser Deprotonierungsstufe ebenfalls nur schwer bildet.
Gleichung?
Bis zum 3. Äquivalenzpunkt:
Gleichung?
Nach kurzem Anstieg des pH-Wertes, entsteht ein weiteres Puffersystem aus Hydrogenphosphat und Phosphat vor. Bis zum dritten Äquivalenzpunkt, welcher aus der Auftragung nicht hervorgeht, liegt folgendes Gleichgewicht vor.
Gleichung?
Der dritte Äquivalenzpunkt ist nicht zu erkennen, da Phosphat als schwache Base reagiert. Somit kommt es zu einer Rückbildung von Hydrogenphosphat, welches wieder mit den Hydroxid-Ionen der Natronlauge neutralisiert wird.
Gleichung?
Bestimmung des ersten Äquivalenzpunktes und des pKs-Wertes:
Gleichung?
Der erste Äquivalenzpunkt befindet sich am steilsten Punkt des ersten pH-Anstieges. Dieser wird mit der Drei-Geraden-Methode ermittelt. Der Halbäquivalenzpunkt befindet sich bei der Hälfte des Zugegebenen Volums an Natronlauge, welche am Äquivalenzpunkt verbraucht wurde. Da die Konzentration an Phosphorsäure und Dihydrogenphosphat am Halbäquivalenzpunkt gleich ist, folgt aus der Henderson-Hasselbalch-Gleichung, dass der pH-Wert gleich dem pKs-Wert ist. Gleiches kann auch für den zweiten Äquivalenzpunkt angewendet werden. Die ermittelten pKs-Werte werden mit den entsprechenden Literaturwerten verglichen und es stellt sich heraus, dass diese den pKs-Werten der Phosphorsäure ähneln. Somit lässt sich aus den pKs-Werten schließen, dass es sich bei der Säure in Cola um Phosphorsäure handeln muss.
Gleichung?
Des Weiteren kann die Konzentration an Phosphorsäure ermittelt werden, indem die Konzentration an Dihydrogenphosphat am ÄP berechnet wird.
Gleichung?
Am ÄP gilt:
Gleichung?
Nach Umformung ergibt sich:
Gleichung?
Auflösen nach der gesuchten Konzentration der Säure:
Gleichung?
Die Konzentration der Base ist bekannt, das Volumen der Base kann am ÄP abgelesen werden und das Volumen der Säure ist ebenfalls bekannt. Nach einsetzten der Werte in die Gleichung ergibt sich für die Säure eine Konzentration von.
Gleichung?
Mit der Konzentration kann letztlich die enthaltene Masse an Phosphorsäure in der Cola bestimmt werden. Hierfür gilt:
Gleichung?
Mit eingesetzten Werten ergibt sich:
Gleichung?
Es befinden sich also 0,033 Gramm Phosphorsäure in 100 mL Cola. Dieser Wert kann ebenfalls mit den Mengenangaben des Herstellers überprüft werden.
Entsorgung
Die Lösungen werden im Abfallbehälter für Säure-Base gegeben.
Literatur
D. Wiechoczek, http://www.chemieunterricht.de/dc2/tip/08_04.htm (Zuletzt abgerufen am 01.08.2017 15:44)
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.