| Thema: Messung der Reaktionsgeschwindigkeit und Katalyse | Tags: Reaktionsgeschwindigkeit | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
3 Stative mit Stativklemmen, Kolbenprober, kurzer Schlauch, Schlauchklemmen, 5 mL Spritze mit Kanüle, Reagenzglas mit seitlichem Abgang, Stoppuhr, Septum
Chemikalien
salzsaure Lösungen (c = 2 m, 1 m, 0.1 m), Magnesiumpulver
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Magnesium | H228-H261-H252 | -- |  |
| Salzsäure 0,1 M | H290 | -- |  |
| Salzsäure 0,1 M | H290 | -- |  |
| Salzsäure 1 M | H290-H315-H319-H335 | P261-P305+P351+P338 |   |
| Salzsäure konz. | H314-H335 | -- |   |
Durchführung
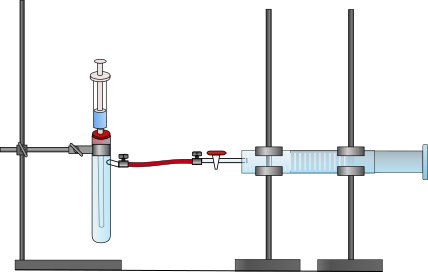
Die Apparatur wird wie in Abbildung 2 aufgebaut. Wichtig ist hierbei, dass der Kolbenprober nicht eingespannt wird, sondern nur auf den Stativklemmen aufliegt!
In das Reagenzglas mit Abgang wird eine Spatelspitze Magnesiumpulver gegeben und das Reagenzglas wiederverschlossen. Die Spritze wird mit 3 mL 0.1 m salzsauren Lösung befüllt und durch das Septum geführt. Der Kolbenprober wurde zuvor auf ein Volumen von 0 mL eingestellt. Sobald durch die Spritze die salzsaure Lösung in das Reagenzglas getropft wird, wird die Zeit gemessen und sobald ein Volumen von 10 mL erreicht ist, die Zeit gestoppt. Der Versuch wird auch mit den salzsauren Lösungen der Konzentrationen von 1 m und 2 m durchgeführt.
Beobachtung
Sobald die salzsaure Lösung auf das Magnesiumpulver tropft, ist eine Reaktion zu beobachten und der Stopfen des Kolbenprobers wird herausgedrückt. Die Messergebnisse sind in Tabelle 1 dargestellt.
Tabelle 1: Messergebnisse des Versuchs.
| Konzentration | Zeit | |
|---|---|---|
| Messung 1 | 0,1 | 4.07 |
| Messung 2 | 1 | 0.9 |
| Messung 3 | 2 | 0.35 |
Deutung
Die salzsaure Lösung reagiert mit Magnesium unter anderem zu Wasserstoff-Gas, welches den Stopfen des Kolbenprobers herausdrückt.
Um die Reaktionsgeschwindigkeit zu berechnen, muss zuerst die Stoffmenge des entstandenen Wasserstoff-Gases bei einem Volumen von 10 mL ermittelt werden. Hierfür wird die Annahme gemacht, dass es sich um ein ideales Gas handelt und somit das ideale Gasgesetz angewendet werden kann.
Nach Umformung ergibt sich:
Für das Volumen werden 10 mL eingesetzt, für die Temperatur und den Druck werden die Werte der Standardbedingungen angenommen, da im Labor annähernd 25°C und ein Druck von 1 bar vorherrschten. R beschreibt die universelle Gaskonstante.
Des Weiteren muss die Konzentration der Protonen berechnet werden. Dies erfolgt über die Formel:
Hierbei muss die doppelte Stoffmenge an Wasserstoff-Gas genommen werden, da doppelt so viele Protonen benötigt werden, um ein Wasserstoff-Gas-Molekül zu bilden.
Die Reaktionsgeschwindigkeiten für die verschiedenen salzsauren Lösungen lassen sich über folgende Formel berechnen:
Für die einzelnen Konzentrationen ergeben sich demnach folgende Reaktionsgeschwindigkeiten:
Tabelle 2: Die Reaktionsgeschwindigkeiten der einzelnen Messungen.
| Messung | Reaktionsgeschwindigkeit |
|---|---|
| 1 | 0.065 |
| 2 | 0.296 |
| 3 | 0,762 |
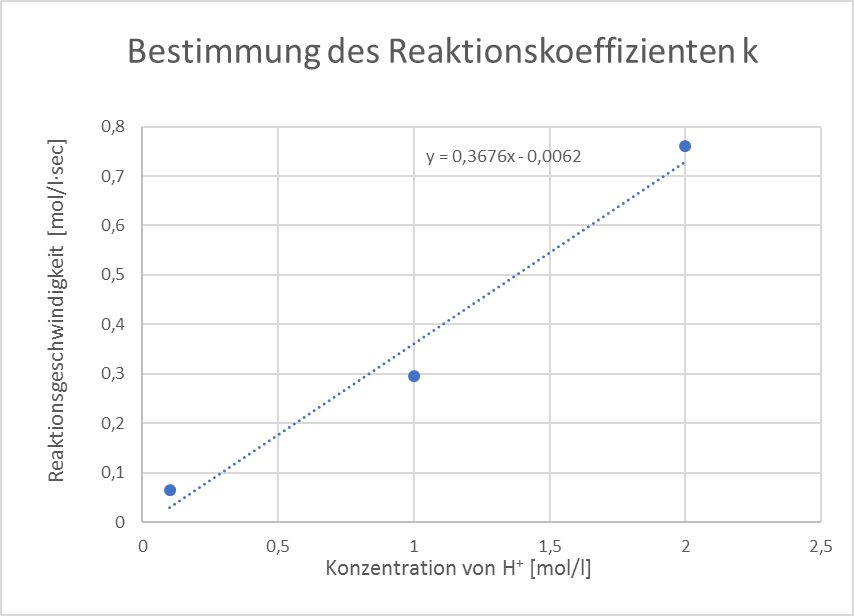
Die Konzentrationen werden nun gegen die Reaktionsgeschwindigkeit aufgetragen um den Geschwindigkeitskoeffizienten k aus dem Geschwindigkeitsgesetzt der Reaktion zu ermitteln.
Der Geschwindigkeitskoeffizient ist die Steigung der Geraden und beträgt: . Der Geschwindigkeitskoeffizient hängt von der Temperatur und von der Substanz ab auf welche sich der Geschwindigkeitskoeffizient bezieht und wird auch als Proportionalitätskonstante bezeichnet.
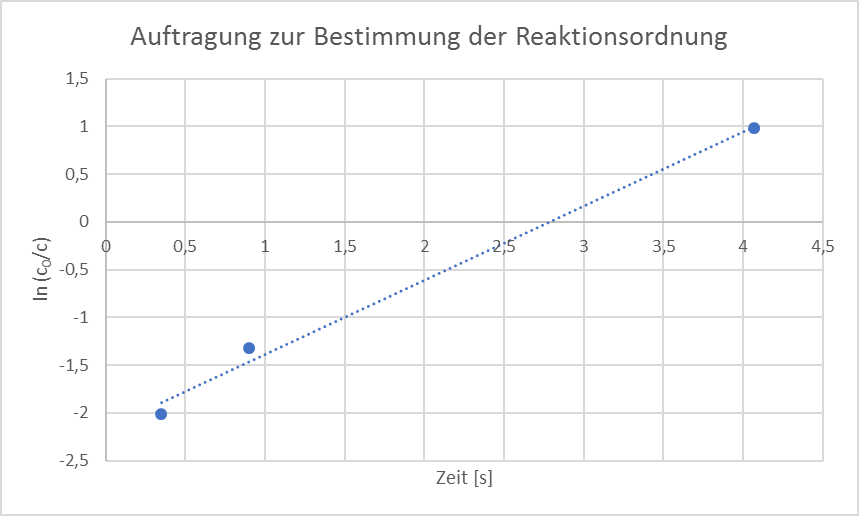
Aus einer weiteren Auftragung lässt sich ebenfalls die Reaktionsordnung ermitteln. Hierbei muss die Zeit gegen den natürlichen Logarithmus der Konzentration durch die Anfangskonzentration dividiert werden.
Tabelle 3: Werte des natürlichen Logarithmus der Konzentration geteilt durch die Anfangskonzentration bei den Messwerten.
| ln [c/c0] | Zeit t [s] |
|---|---|
| 0.982 | 4.07 |
| -1.320 | 0.9 |
| -2.013 | 0.35 |
Die Auftragung der Daten ergibt eine Gerade, woraus sich schließen lässt, dass es sich um eine Reaktion erster Ordnung handeln muss. Bei Reaktionen erster Ordnung ist die Reaktionsgeschwindigkeit nur von der Konzentration eines Ausgangsstoffes abhängig.
Entsorgung
Die Lösungen werden im Abfallbehälter für Schwermetalle entsorgt.
Literatur
[1] H. Keune, H. Böhland, Chemische Schulexperimente – Band 3: Allgemeine, physikalische und analytische Chemie, Chemie und Umwelt, Volk und Wissen Verlag, 1. Auflage, 2001, S. 88f.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.