| Thema: Korrosion und Korrosionsschutz | Tags: Korrosionsschutz, Opferanode | Klassenstufen: 7-8 | Versuchsart: SV |
Materialien
3 Petrischalen, Schmirgelpapier
Chemikalien
Eisennägel, Wasser, Kochsalz, Kaliumhexacyanoferrat(III) („rotes Blutlaugensalz“), Magnesiumband, Kupferdraht
Durchführung
Drei Eisennägel werden mit Schmirgelpapier abgeschmirgelt. Magnesiumband und Kupferdraht werden ebenfalls abgeschmirgelt. Ein Nagel wird anschließend mit Magnesiumband umwickelt, ein anderer mit Kupferdraht. Der dritte Nagel bleibt unverändert. Die Nägel werden in den Petrischalen in eine konzentrierte Kochsalzlösung gelegt, welcher zuvor ein Spatel Kaliumhexacynoferrat(III) beigemischt wurde.
Beobachtung
Der Nagel mit dem Kupferband ist nach kurzer Zeit von tiefblauen Schlieren umgeben. Auch um den unveränderten Nagel sind blaue Schlieren zu beobachten, allerdings in geringerer Intensität. Am Nagel mit dem Magnesiumband ist zunächst keine Blaufärbung zu beobachten. Am Magnesiumband findet leichte Gasentwicklung statt.
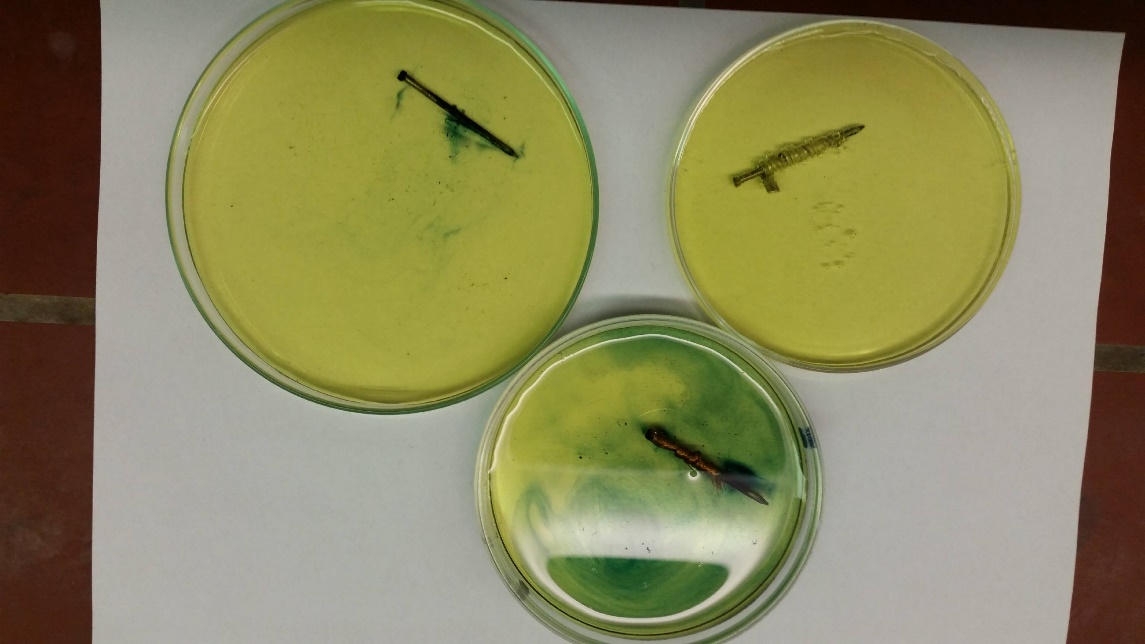
Deutung
Der unbehandelte Nagel reagiert in einer Sauerstoffkorrosionsreaktion, welche durch das NaCl in der Lösung katalysiert wird, mit Wasser und Luftsauerstoff. Eine dabei entstehende Eisenverbindung wird dabei durch die Blaufärbung des roten Blutlaugensalzes nachgewiesen.
Magnesium ist ein unedleres Metall als Eisen und reagiert als solches bevorzugt mit Luftsauerstoff und Wasser. Es wird daher an Stelle des Eisens korrodiert und funktioniert als sogenannte Opferanode.
Kupfer ist ein edleres Metall als Eisen und ist als solches stärker bestrebt, in elementarer Form erhalten zu bleiben und nicht weiter zu reagieren. Eisen fungiert in diesem Fall als Opferanode für das Kupfer im Kupferdraht: Es wird anstelle des Kupfers korrodiert, was den auch ohne Kupfer ablaufenden Sauerstoffkorrosionsprozess noch zusätzlich verstärkt.
Fachliche Ausw.: Bei der nachgewiesenen „Eisenverbindung“ handelt es sich um Eisen(II)-Ionen, die mit dem Kaliumhexacyanoferrat(III) lösliches Berliner Blau bilden:
Fe3+(aq) + K3[Fe(CN)6](aq) → 2 K+(aq) + K[FeIIFeIII(CN)6](aq)
Bei der Reaktion von Magnesium als Opferanode entsteht Wasserstoffgas und eine Schicht Magnesiumhydroxid auf dem Magnesiumband:
Mg(s) + 2 H2O(l) → Mg(OH)2(s) + H2(g)
Entsorgung
der Lösung erfolgt über den Abfluss. Die Eisennägel werden über den Feststoffabfall entsorgt.
Literatur
C. E. Mortimer, U. Müller: Chemie, Auflage 10., S. 357 ff., S. 378, Thieme Verlag, 2010.
M. Tausch, M. v. Wachendonk, Chemie SII: Stoff-Formel-Umwelt, S. 215-217, 1993.
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.
