| Thema: Elektrolyse | Tags: Elektrolyse, Wasser, verdünnte Schwefelsäure | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
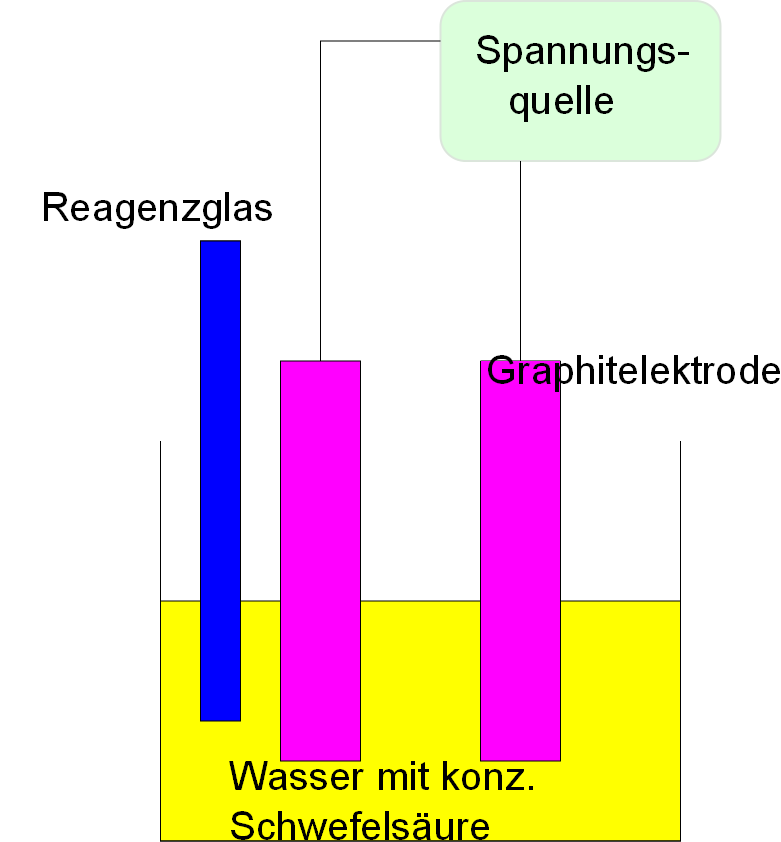
Große Glasschüssel, 2 Reagenzgläser, Trichter, Graphitelektroden, Spannungsquelle, Kabelverbindungen, Glimmspan, Bunsenbrenner, Stativmaterial, Isolierstützen, Vielfachmessgerät, Pipette.
Chemikalien
Schwefelsäure, Wasser.
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Schwefelsäure 10% | H319-H315 | P280-P302+P352-P305+P351+P338 |  |
| Wasser | - | - |
Durchführung
Eine Schüssel wird mit Wasser gefüllt und wenige Milliliter Schwefelsäure werden zugegeben. Zwei Reagenzgläser werden in das
Wasser getaucht, um sie komplett zu füllen. Es darf keine Luft mehr enthalten sein. Nun werden die Reagenzgläser gedreht, damit ihre Öffnung nach unten zeigt. Luft darf dabei nicht in die Reagenzgläser gelangen. Die Elektroden werden schräg in das Wasser eingetaucht und mit Isolierstützen fixiert. Anschließend werden die Elektroden mit der Spannungsquelle und einem Vielfachmessgerät verbunden (Parallelschaltung). Es wird eine Spannung von 12 V angelegt (Gleichspannung verwenden). Die entstehenden Gase werden unter Wasser in Reagenzgläser aufgefangen, indem diese schräg eingespannt werden. Die mit Gas gefüllten Reagenzgläser werden mit dem Daumen verschlossen. Das an der Kathode entstandene Gas wird mittels Knallgasprobe untersucht. Die Glimmspanprobe wird mit dem an der Anode entstandene Gas durchgeführt.
Tipp: Um die Füllung der Reagenzgläser mit den entstehenden Gasen zu beschleunigen, sollten die Reagenzgläser schräg unter Wasser eingespannt werden, um die Gasbläschen optimal in das Reagenzglas zu leiten. Alternativ können auch zwei SuS als Assistenten eingesetzt werden, die dann jeweils ein Reagenzglas an die entsprechende Elektrode halten. Diese können ihre Beobachtungen der Mitschülern mitteilen. Alternativ kann ein Hoffmannscher Zersetzungsapparat verwendet werden.
Beobachtung
Die Gasentstehung an der Kathode dauert etwas länger als an der Anode. Die Knallgasprobe ist an der Anode positiv. An der Kathode ist die Glimmspanprobe positiv.
Deutung
An der Kathode ist Wasserstoff entstanden, da die Knallgasprobe positiv war. Da die Glimmspanprobe positiv war, ist an der Anode Sauerstoff entstanden. Wasser wurde in diesem Versuch oxidiert und reduziert. Folgende Elektrolysevorgänge laufen ab:
Oxidation: 6 H2O (l) → O2 (g) + 4 OH- (aq) + 4 e-
Reduktion: 4 H3O+ (aq) + 4 e- → 2 H2 (g) + 4 H2O (l)
Redoxreaktion: 2 H2O (l) → 2 H2 (g)+ O2 (g)
Eigendissoziation des Wassers:
H2O (l)+ H2O (l)→ H3O+ (aq) + OH- (aq),
deshalb liegen auch zu Beginn Oxonium- und Hydroxidionen vor. Es handelt sich bei der Eigendissoziation von Wasser um eine Gleichgewichtsreaktion.
Die Schwefelsäure wird als (saurer) Elektrolyt verwendet um die Leitfähigkeit des Wassers zu erhöhen.Entsorgung
Die Lösung wird neutralisiert und über das Abwasser entsorgt.
Literatur
[1] M. Nordholz & R. Herbst-Irmer (2009), Skript zum anorganisch-chemischen Grundpraktikum für Lehramtskandidaten, Göttingen: Universität Göttingen.Schülerversuche
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.