| Thema: Alkohole und deren Eigenschaften | Tags: Oxiderbarkeit, primärer Alkohol, sekundärer Alkohol, tertiärer Alkohol | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
3 Petrischalen, Messpipetten, Peleusball, 2 Bechergläser
Chemikalien
Ethanol (96%iger), Isopropanol, tert-Butanol, 1 M Natronlauge, Kaliumpermanganat-Lösung (c = 0,006 mol/L)
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Ethanol 98% | H225 | -- |  |
| 2-Propanol | H225-H319-H336 | -- |   |
| tert-Butanol | H225-H332-H319-H335 | -- |   |
| Natronlauge 1 M | H314 | P280-P301+P330+P331-P305+P351+P338-P309+P310 |  |
| Kaliumpermanganat | H272-H302-H410 | -- |    |
Durchführung
Es wird aus 14 mg Kaliumpermangant und 15 mL destilliertem Wasser eine 0,006 molare Kaliumpermangant-Lösung angesetzt. Zu dieser Lösung werden 15 mL 1M-Natronlauge hinzugefügt. Die Lösung wird dann auf drei Petrischalen aufgeteilt. In jede Petrischale werden dann 2 mL eines Alkohols gegeben.
Beobachtung
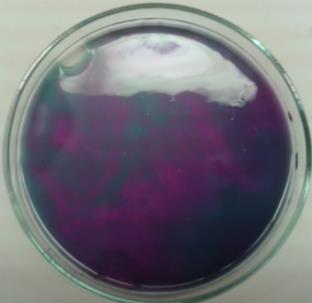
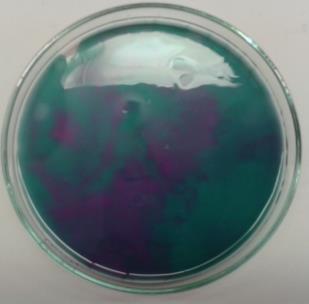
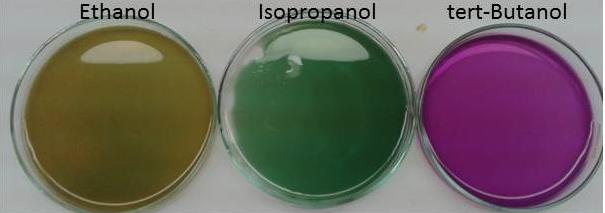
Die Lösung, zu der Ethanol pipettiert wurde, färbt sich von violett über grün zu gelb-braun. In der Lösung, in die Isopropanol hinzugefügt wurde, kommt es zu einem Farbumschlag von violett nach grün. Die Lösung mit tert-Butanol bleibt farblich unverändert.
Deutung
Der Versuch zeigt die unterschiedliche Oxidierbarkeit von primären (Ethanol), sekundären (Isopropanol) und tertiären (tert-Butanol) Alkoholen. Als Oxidationsmittel wirkt das Kaliumpermanganat, das die Alkohole bis zu unterschiedlichen Oxidationsstufen oxidiert.
Die Unterteilung in primäre, sekundäre und tertiäre Alkohole erfolgt anhand der Position der Hydroxylgruppe im Molekül, d.h. man unterscheidet die Alkohole nach der Anzahl der Nichtwasserstoffnachbarn des Kohlenstoffatoms, an welchem sich die Hydroxylgruppe befindet. So trägt bei primären Alkoholen das C-Atom mit der Hydroxylgruppe noch zwei Wasserstoffatome, bei sekundären trägt das C-Atom mit der Hydroxylgruppe noch ein Wasserstoffatom und bei tertiären Alkoholen weist das C-Atom mit der Hydroxylgruppe kein weiteres Wasserstoffatom auf.
Primäre Alkohole wie Ethanol werden durch Permanganat-Ionen zu Aldehyden und Carbonsäuren reduziert. Dabei verläuft die Oxidation des Ethanols in zwei Schritten unter Protonenverbrauch. Im ersten Schritt entstehen aus Ethanol entsteht Ethanal. Dabei werden die Mangan-Ionen auf die Oxidationsstufe +6 reduziert, was an der Grünfärbung der Lösung deutlich wird. In weiteren Schritt werden die Aldehyde zu Carbonsäuren, im Falle des Ethanols zu Ethansäure, oxidiert und die Mangan-Ionen auf Oxidationsstufe +4 reduziert. Man erhält Braunstein, was an der gelblich-braunen Färbung der Lösung auszumachen ist.
Oxidation:
Reduktion:
Gesamtgleichung:
Sekundäre Alkohole wie das Isopropanol werden von Kaliumpermangant nur bis zum Keton oxidiert. Die Permanganat-Ionen werden nur zur Oxidationsstufe +6 reduziert, was an der grünen Farbe der Lösung zu erkennen ist.
Oxidation:
Reduktion:
Tertiäre Alkohole wie das tert-Butanol (2-Methyl-Propan-2-ol) können von Kaliumpermanganat nicht oxidiert werden, da ohne Spaltung einer C-C-Bindung keine Carbonylgruppe ausgebildet werden kann. Dies ist an der konstanten violetten Färbung der Lösung auszumachen.
Entsorgung
Die Lösungen werden mit Natriumthiosulfat behandelt und im Schwermetallabfall entsorgt.
Literatur
CHIDS. Philipps-Universität-Marburg. http://chids.online.uni-marburg.de /dachs/experimente/005oxidierbarkeit _prim_sek_ter_alkohole.xml (zuletzt aufgerufen am 15.08.2014 um 10:57 Uhr).
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.