| Thema: Einfache Elektrolysen und Leitfähigkeit | Tags: Wasserstoff, Sauerstoff | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
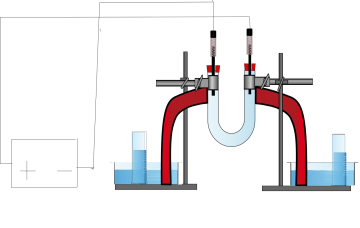
2 pneumatische Wannen, U-Rohr, 2 Kohleelektroden im Stopfen, Spannungsquelle, Kabel, 2 Krokodilklemmen, 2 Stative, 2 Klemmen zum Befestigen des Rohrs, 2 x 50 mL Messzylinder
Chemikalien
Wasser, Schwefelsäure (Wasserstoff und Sauerstoff entstehen erst durch die Reaktion)
Durchführung
Das U-Rohr wird zwischen die Stative eingespannt. Es wird anschließend mit Wasser gefüllt und die Stopfen mit den Kohleelektroden werden aufgesetzt. Die Zuläufe der Schenkel werden jeweils mit 2 pneumatischen Wannen verbunden. In diese werden mit Wasser gefüllte Messzylinder mit der Öffnung nach unten gehalten. Die Kohleelektroden werden mit der Spannungsquelle verbunden und als Anode (+-Pol) und Kathode (-Pol) geschaltet. Durch die Krokodilklemmen werden sie mit den Kohleelektroden verbunden.
Beobachtung
Im Verlauf der Reaktion wird das Wasser in den Messzylindern verdrängt. Das Gasvolumen in dem Zylinder, dessen pneumatische Wanne auf der Anodenseite liegt, ist etwa halb so groß wie das Gasvolumen auf der Kathodenseite.
Deutung
Anode/Oxidation: 6 H2O (l) → O2 (g) + 4 OH- (aq) + 4 e-
Kathode/Reduktion: 4 H3O+ (aq) + 4 e- → 2 H2 (g) + 4 H2O (l)
Redoxreaktion: 2 H2O (l) → 2 H2 (g) + O2(g)
Auf der Kathodenseite (Minuspol) ist Wasserstoff durch Reduktion von Oxoniumionen entstanden. Der Wasserstoffanteil ist etwa doppelt so hoch wie der Sauerstoffanteil. Dies entspricht der tatsächlichen Zusammensetzung des Wassers.
Entsorgung
Das Wasser wird in den Säure-Base-Abfall gegeben.
Literatur
Blume, www.chemieunterricht.de/dc2/echemie/h2o-elek.htm, 2001, aufgerufen am 08.08.2015
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.