| Thema: Stoffkreisläufe | Tags: Kalk, Calciumcarbonat, Calciumoxid | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
Teil 1: Becherglas, Reagenzglas, durchbohrter Stopfen mit Gasableitungsrohr, Gasbrenner, Waage, Spatel, 2 Stativständer, Stativklemmen
Teil 2: 2 Bechergläser (100 mL), Spatel, Indikatorpapier
Teil 3: Materialien aus 1 und 2
Chemikalien
Calciumcarbonat, Calciumoxid
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Calciumcarbonat | -- | -- | |
| Calciumoxid | H318 | P280-P305+P351+P338-P309+P310 |  |
| Calciumhydroxid Pulver | H318 | P280-P305+P351+P338-P309+P310 |  |
| Universalindikator 0-14 | -- | -- |
Durchführung
Kalkbrennen:
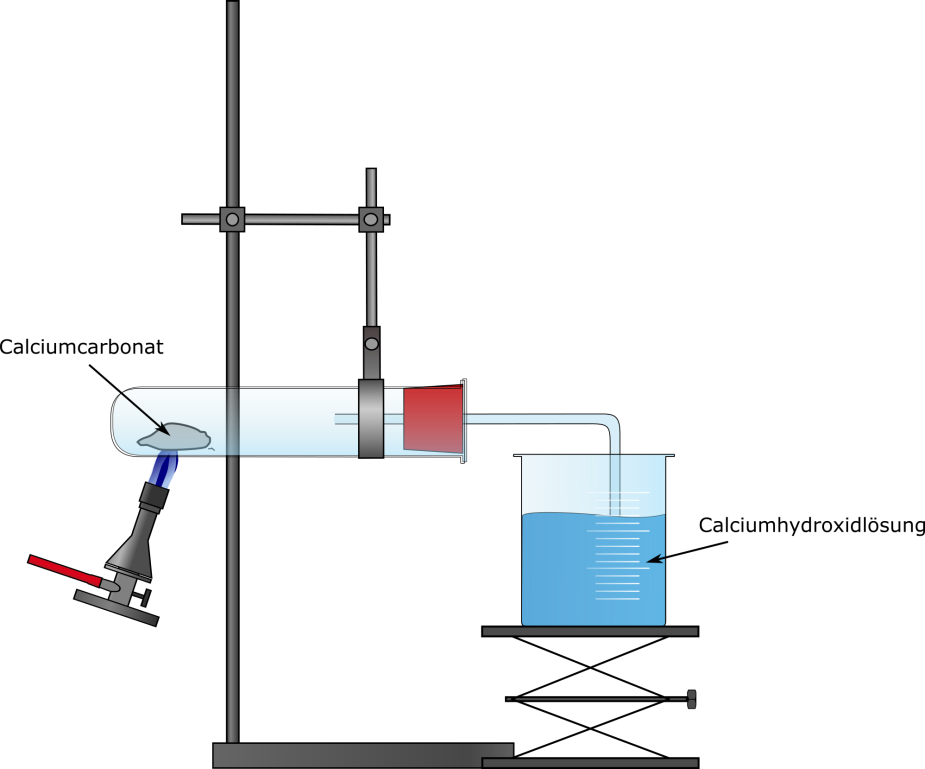
Ein Spatellöffel Calciumcarbonat wird in ein Reagenzglas gegeben. Das Reagenzglas wird schräg an einem Stativ befestigt und der Stopfen mit Gasableitungsrohr aufgesetzt. In einem Becherglas werden 10 mL Kalkwasser vorgelegt. Das Gasableitungsrohr sollte in das Kalkwasser eintauchen. Nun wird das Calciumcarbonat mit rauschender Brennerflamme erhitzt.
Kalklöschen:
Das aus dem ersten Teilversuch erhaltene Produkt wird in einem Becherglas zunächst mit einigen Tropfen destilliertem Wasser verrührt. Dann werden nach und nach bis zu 20 ml Wasser hinzugefügt. Der pH-Wert der Lösung wird mit Universalindikatorpapier bestimmt. Es wird ebenso der pH-Wert einer Calciumcarbonatlösung mittels Universalindikatorpapier bestimmt.
Abbinden von Löschkalk:
Die in 3.2 erhaltene Calciumhydroxidlösung wird filtriert und in einem Verhältnis von 1:1 mit Sand vermischt und anschließend so viel Wasser hinzugegeben, dass ein zähflüssiges Gemisch entsteht. Es könnten nun Tonscherben oder Ähnliches mit dem Kalkmörtel verbunden werden und diese zum Trocknen stehen gelassen werden.
Beobachtung
Kalkbrennen:
Es entsteht ein Gas. Das Kalkwasser trübt ein. Der Feststoff bleibt weiß.
Kalklöschen:
Es findet eine starke Wärmeentwicklung statt, die Temperatur steigt an. Außerdem reagiert die Lösung stark alkalisch. Das Indikatorpapier färbt sich dunkelgrün (pH 12). Der pH-Wert ist höher als bei der Calciumcarbonatlösung, bei welcher das Indikatorpapier gelb verfärbt ist (pH 8).
Abbinden von Löschkalk:
Es entsteht eine grau-weiße Masse.

Deutung
Kalkbrennen:
Durch Erhitzen von Calciumcarbonat wird Kohlenstoffdioxid freigesetzt. Dieser wird mithilfe der Calciumhydroxidlösung nachgewiesen. Der weiße Niederschlag im Becherglas ist Calciumcarbonat:.
Ca 2+ (aq) + 2 OH− (aq) + CO2 (g) → CaCO3 (s) + H2O (l)
Im Reagenzglas entsteht nach dem Erhitzen Calciumoxid, sogenannter „Branntkalk“.
CaCO3 (s) → CaO (s) + CO2 (g)
Kalklöschen:
Die Reaktion ist stark exotherm. Es entsteht Calciumhydroxid, welches basisch reagiert.
CaO(s) + H2O (l) → Ca(OH)2 (aq)
Abbinden von Löschkalk:
Das Calciumhydroxid reagiert mit Kohlenstoffdioxid aus der Luft wieder zu Calciumcarbonat. Der Kalkkreislauf ist somit geschlossen.
Ca2+ (aq) + 2 OH− (aq) + CO2 (g) → CaCO3 (s) + H2O (l)
Entsorgung
Das Calciumoxid wird in 3.2 weiterverwendet. Das Kalkwasser wird neutralisiert und im Abfluss entsorgt. Das Reaktionsprodukt wird in 3.3 weiterverwendet.
Literatur
Blume R. (30.01.2012): http://www.chemieunterricht.de/dc2/haus/v142.htm (Zuletzt aufgerufen am 07.08.2015 um 15:26).
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.