| Thema: Salze und Salzbildung | Tags: Kupferchlorid, Eisenchlorid, Natriumhydroxid, Diffusion | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
Petrischale, Spatel
Chemikalien
Wasser, Natriumhydroxid, Kupferchlorid-Dihydrat, Eisen(III)-chlorid
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Wasser | - | - | |
| Natriumhydroxid | H314 | -- |  |
| Kupfer(II)-chlorid-2-H2O | H302-H319-H315-H410 | P280-P273-P302+P352-P305+P351+P338-P309+P311 |   |
| Eisen(III)-chlorid-6-H2O | H290-H302-H315-H318 | P280-P305+P351+P338 |   |
Durchführung
Die Petrischale wird etwa bis 1 cm Höhe mit Wasser befüllt. An einer Stelle wird in Randnähe das Salz vorsichtig in das Wasser gegeben, ohne es in Bewegung zu bringen. Auf gegenüberliegender Seite werden ebenfalls nahe des Randes vorsichtig 2 Natriumhydroxid-Plätzchen ins Wasser gelegt.
Beobachtung
Eine grüne bzw. gelbliche Färbung ist dort zu erkennen, wo die Salze Kupferchlorid-Dihydrat bzw. Eisen(III)-chlorid ins Wasser gegeben wurden. Die Färbung breitet sich aus. Ausgehend von den Natriumhydroxid-Plätzchen sind Schlieren zu erkennen, die sich ebenfalls ausbreiten. Die Lösung bleibt farblos. Bei Berührung der beiden farblich unterscheidbaren Lösungen bildet sich ein neuer Feststoff.
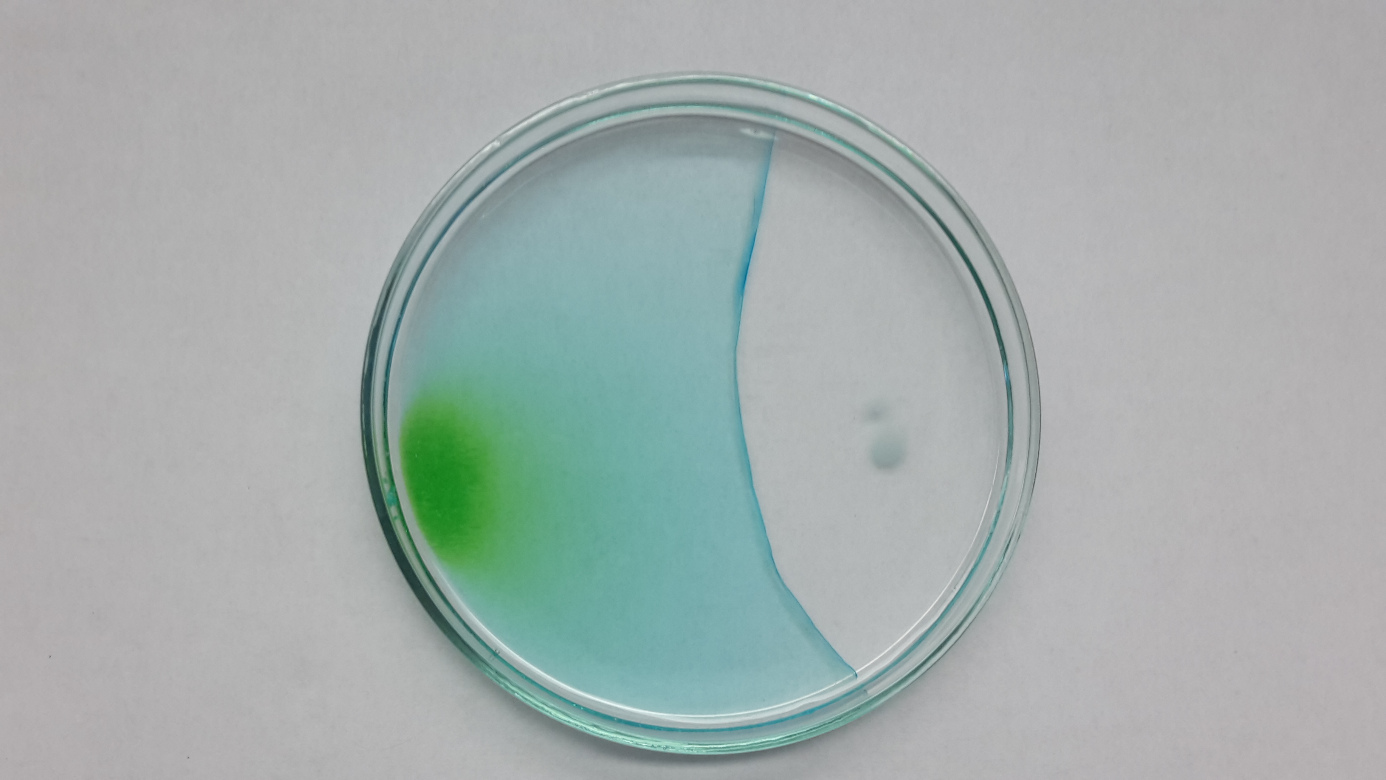

Deutung
Das jeweilige Salz und Natriumhydroxid lösen sich im Wasser und diffundieren. An der Stelle, wo es zum Kontakt kommt, reagieren die beiden Substanzen miteinander.
Kupferchlorid-Dihydrat mit Natriumhydroxid:
CuCl2 (aq) + 2 NaOH (aq) → Cu(OH)2 (s) + 2 Na+ (aq) + 2 Cl- (aq)
Eisenchlorid mit Natriumhydroxid:
FeCl3 (aq) + 3 NaOH (aq) → Fe(OH)3 (s) + 3 Na+ (aq) + 3 Cl- (aq)
Entsorgung
Feststoff und Lösung können im Behältnis für schwermetallhaltige Abfälle entsorgt werden.
Literatur
H. Schmidkunz, Chemische Freihandversuche, Kleine Versuche mit großer Wirkung, Aulis Verlag, 2011, S. 262.
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.