| Thema: Alkalimetalle | Tags: Alkalimetalle, Reaktion mit Wasser, Exotherme Reaktion | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
3 Glaswannen oder große Bechergläser, Filterpapier, 100 mL-Becherglas, Pipette, Pinzette, Messer, Holzbrett
Chemikalien
Lithium, Natrium, Kalium, demin. Wasser, Phenolphthalein, Ethanol
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Lithium | H260-H314-EUH014 | -- |   |
| Natrium | H260-H314-EUH014 | -- |   |
| Kalium | H260-H314-EUH014 | -- |   |
| Phenolphthalein | H350-H341-H361f | -- |  |
| Lithiumhydroxid | H301-H314 | P280-P301+P330+P331-P304+P340-P309+P310 |   |
| Kaliumhydroxid | H302-H314 | -- |   |
Durchführung
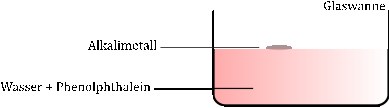
Die drei Glaswannen werden jeweils zu einem Drittel mit demin. Wasser gefüllt, wenigen Tropfen Phenolphthalein versetzt und nebeneinander aufgestellt.
Nun wird mit der Pinzette ein halberbsengroßes Stück Lithium aus dem Aufbewahrungsbehälter genommen und mit dem Messer die Passivierungsschicht entfernt. Anschließend wird das Alkalimetall in eine der Glaswannen gegeben und die Reaktion beobachtet. Mit den Alkalimetallen Natrium und Kalium wird analog verfahren.
Im zweiten Teil dieses Versuchs wird jeweils ein Stück Filterpapier auf die Wasseroberfläche der Glaswannen gelegt, in die vorher Lithium bzw. Natrium gegeben wurden. Nun werden auf die Filterpapiere analog zur oben beschriebenen Vorgehensweise (Entfernen der Passivierungsschicht) halberbsengroße Stückchen Lithium und Natrium gegeben.
Beobachtung
Sobald Lithium die Wasseroberfläche berührt, bewegt es sich zischend und sprudelnd über die Wasseroberfläche und eine Gasentwicklung ist zu beobachten. Die wässrige Lösung verfärbt sich pink.
Natrium zeigt ein ähnliches Verhalten, das jedoch etwas heftiger ist. Natrium zeigt bei Berührung mit Wasser ein stärkeres Zischen und bildet eine Kugel, die auf der Oberfläche tanzt, wobei eine Gasentwicklung beobachtet werden kann. Die Lösung verfärbt sich pink.
Kalium zeigt das intensivste Verhalten. Es zischt am stärksten von den drei untersuchten Alkalimetallen und tanzt kurz nach Berührung der Wasseroberfläche mit starker Gasentwicklung heftig und unter Flammenbildung über die Oberfläche. Das Wasser verfärbt sich pink.
Wird Lithium auf das feuchte Filterpapier gegeben, zischt und sprudelt es heftig, wobei eine Gasentwicklung zu beobachten ist. Die Bewegung über die Oberfläche wird allerdings eingeschränkt.
Natrium zeigt ein ähnliches Verhalten, allerdings wird nun das Filterpapier unter dem Natriumstück entzündet, was durch kleine auflodernde Flammen zu beobachten ist.
Deutung
Alkalimetalle reagieren mit Wasser, wobei eine alkalische Lösung entsteht (Pinkfärbung des mit Phenolphthalein versetzten Wassers). Die Reaktion des Alkalimetalls mit Wasser ist eine stark exotherme Reaktion, bei der eine Gasentwicklung stattfindet. Das Augenmerk soll bei dieser Versuchsdurchführung auf der Stärke der exothermen Reaktion liegen, weil die Reaktivitäten der Alkalimetalle miteinander verglichen werden sollen. Im Falle von Natrium reicht die freigesetzte Energie aus, um das Filterpapier zu entzünden. Es lässt sich anhand der Beobachtung folgende Reihung des exothermen Verhaltens der Alkalimetalle feststellen:
Lithium (keine Entzündung beobachtbar) < Natrium (Entzündung auf Filterpapier) < Kalium (Entzündung bereits ohne Filterpapier).
Entsorgung
Die Entsorgung des Filterpapiers erfolgt im Feststoffabfall. Die Lösungen können nach Neutralisation mit schwacher Salzsäure in den Ausguss gegeben werden.
Dieser Versuch kann zum Einstieg in das Thema „Alkalimetalle“ dienen, um die Gemeinsamkeiten von Alkalimetallen bei der Reaktion mit Wasser darzustellen. Es lassen sich hier auch Trends der Alkalimetalle erkennen und vergleichen. Wenn Alkalimetalle auf Filterpapier gelegt werden, sollte auf die Verwendung von Kalium verzichtet werden, da diese Reaktion bereits mit Wasser sehr heftig auftritt.
Zu beachten ist auch, dass der Einsatz von Phenolphthalein einer Tätigkeitsbeschränkung für Lehrkräfte unterliegt. Dieser sollte daher möglichst vermieden werden.
Literatur
[1] R. Blume, Prof. Blumes Bildungsserver für Chemie, http://www.chemieunterricht.de/dc2/wasser/w-v-16.htm, Zuletzt abgerufen am 03.08.2016 um 22:27 Uhr
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.