| Thema: Alkane, Alkohole, ungesättigte Kohlenwasserstoffe | Tags: Ethanol, molare Masse, Avogadro-Gesetz | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
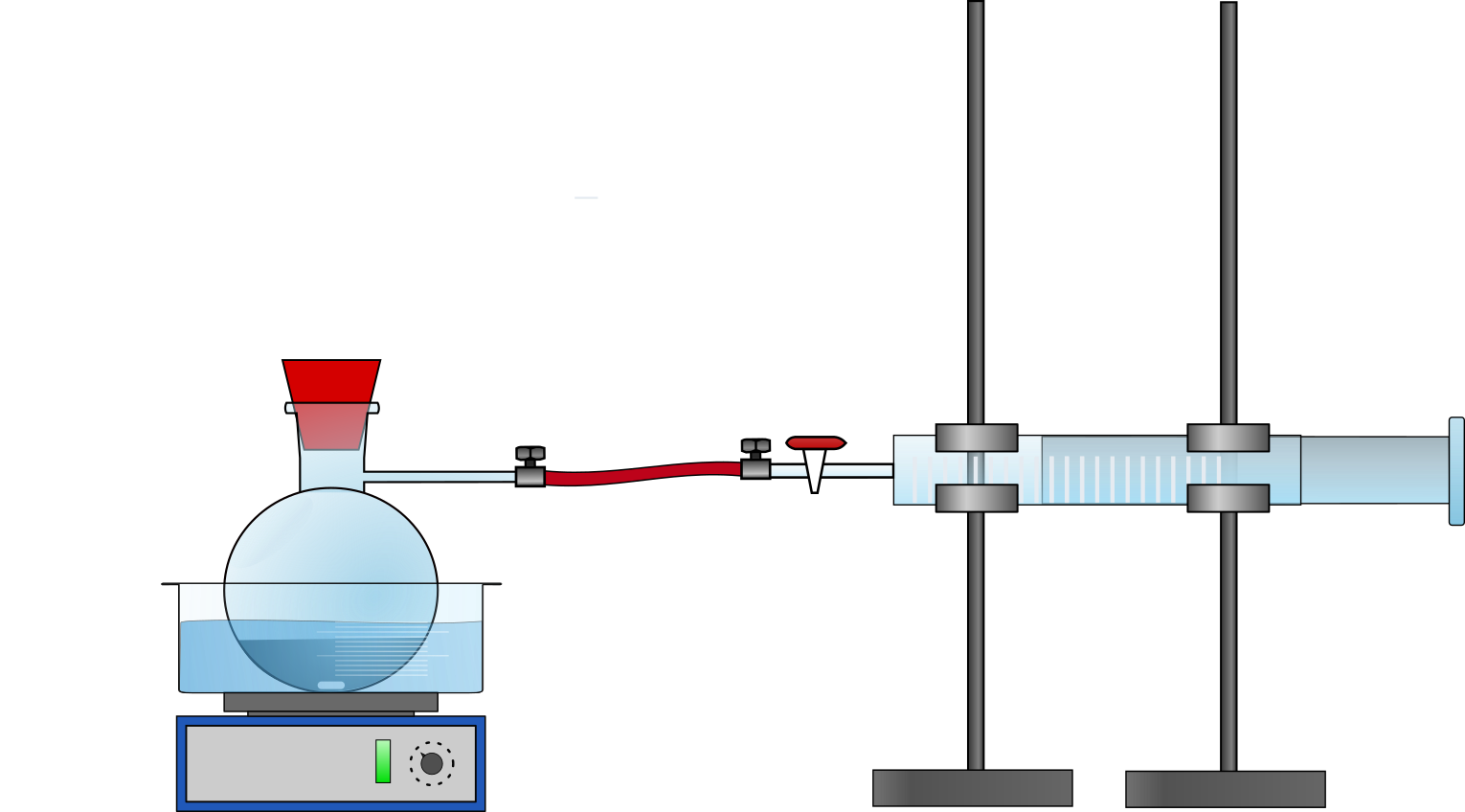
Rundkolben, Stativ mit Klemmen ,Kolbenprober, Perlkatalysator, Schlauch, Schlauchklemmen, Gasbrenner, Pipette mit Peleusball, Kristallisationschale, Heizplatte
Chemikalien
Ethanol
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Ethanol | 225‐319 | 210‐240‐305+351+338‐403+233 |   |
Durchführung
Der Rundkolben wird am Stativ in einem Wasserbad eingespannt. Darüber wird ein Kolbenprober befestigt und mit einem Schlauch mit dem Rundkolben verbunden. In den Rundkolben werden einige Spatelspitzen Perlkatalysator und genau 0,1 mL Ethanol gegeben und mit dem Wasserbad erhitzt, bis das Ethanol verdampft (vgl. Abb. 1). Das entstehende Gasvolumen wird am Kolbenprober abgelesen.
Beobachtung
Das Ethanol verdampft und drückt den Kolbenprober nach oben.
Deutung
Es wurde ein Volumen von 41 mL am Kolbenprober abgelesen. Die molare Masse des Ethanols kann daraus wie folgt berechnet werden:
| n = |
|
= |
|
⇒ | M = |
|
| ρ = |
|
⇔ | m = |
|
⇒ | M = |
|
Mit den Werten
- Vflüssig = 1 · 10−4 L
- ρ = 785 g/L
- VGas = 0,041 L[2]
- VM ≈ 24 L/mol bei 25 °C
| M = |
|
= | 45,95 g/mol |
Zum Vergleich liefert die Literatur MEthanol = 46,1 g/mol[2]. Der Versuch liefert also ein recht genaues Ergebnis.
Entsorgung
Die Entsorgung der Lösung erfolgt im Abfall für organische Lösungsmittel.
Literatur
[1] E. Irmer et al., elemente chemie 7-10, Ernst Klett 2010, S. 288f.
[2] F.-M.Becker et al.Formelsammlung, Duden Patec 2005,S. 121.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.