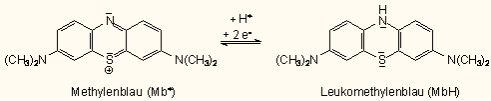| Thema: Katalyse | Tags: Katalyse, Übergangszustand, Gleichgewicht, Redoxreaktion | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
Rundkolben (1 L), Stopfen, Messzylinder, Spatel, Waage.
Chemikalien
Methylenblau, Glucose, Natronlauge (w=10 %), dest. Wasser.
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Methylenblau | H302 | -- |  |
| Glucose | Leider in der Datenbank nicht gefunden - bitte nachschlagen! | ||
| Natronlauge 1 M | H314 | P280-P301+P330+P331-P305+P351+P338-P309+P310 |  |
Durchführung
In einen 1 L-Rundkolben werden 300 mL dest. Wasser und 50 mL Natronlauge (w=10 %) gegeben. In dieser Mischung werden 50 g Glucose gelöst. Danach wird so viel Methylenblaulösung zugegeben, bis eine tiefblaue Färbung erkennbar ist. Die Lösung wird einige Minuten stehen gelassen. Anschließend wird die Lösung stak geschüttelt. Nun wird die Lösung wieder stehen gelassen. Der Vorgang wird mehrmals wiederholt.
Beobachtung
Die Lösung im Rundkolben hat vor Zugabe von Methylenblau eine gelbliche Färbung. Nach Zugabe von Methylenblau ist die Lösung dunkelblau. Nach etwa einer Minute stehen lassen ist eine Entfärbung erkennbar. Nach dem Schütteln färbt sich die Lösung wieder tiefblau. Nach einem erneuten stehen lassen (ca. eine Minute) bleibt die Färbung nur an der Phasengrenze Luft-Flüssigkeit erhalten. Im Zeitverlauf ist eine zunehmende Gelbfärbung der Lösung zu beobachten.
Deutung
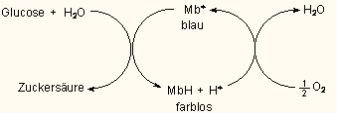
Es handelt sich um eine durch Methylenblau katalysierte Oxidation der Glucose (zu Gluconsäure). Als Katalysator wird Luftsauerstoff verwendet. Die Mitwirkung von Methylenblau zeigt sich durch die Entfärbung. Methylenblau wirkt als Oxidationsmittel. Das alkalische Milieu ist erforderlich, da der Sauerstoff durch Reaktion mit Wasser eingefügt wird und nicht durch Luftsauerstoff. Formal gesehen entstehen dabei Protonen, die eine weitere Reaktion verhindern. Die Reaktionsgleichung für die Oxidation der Glucose lautet:
R-CHO(aq) + H2O(l) ⇌ R-COOH(aq) + 2H+(aq) + 2e-
Diese Protonen werden mit Natronlauge neutralisiert. Dabei verschiebt sich das chemische Gleichgewicht auf die Seite der Produkte (Gluconsäure).
Es laufen die Reaktionen aus Abbildung 3 ab.
Das farblose Leukomethylenblau kann als aktive Übergangsverbindung eines Katalysators angesehen werden (es bildet sich ein Zwischenprodukt). Dabei handelt es sich um eine Gleichgewichtsreaktion. Der Katalysator beschleunigt die Einstellung des Gleichgewichts, nimmt aber keinen Einfluss auf die Lage des chemischen Gleichgewichts.
Methylenblau wird als Redoxindikator eingesetzt. Durch das Schütteln diffundiert Luftsauerstoff in die Lösung und oxidiert das Leukomethylenblau zu Methylenblau.
Die Gelbfärbung der Lösung ist dadurch erklärbar, dass Glucose zunehmend zersetzt wird und das Zersetzungsprodukt der Flüssigkeit eine gelbe Farbe gibt.
Entsorgung
Die Lösung aus dem Rundkolben wird gesammelt und mit den organischen Reststoffen entsorgt.
Literatur
[3] R. Blume, http://www.chemieunterricht.de/dc2/katalyse/vkat-007.htm, 04.01.2005, (zuletzt abgerufen am 02.08.2013 um 15:34 Uhr)[4] H. Roesky (2006), Glanzlichter chemischer Experimentierkunst, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, S. 71 f.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.