| Thema: Batterien und Akkus | Tags: Lithium, Akku, Ionen, Graphit | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
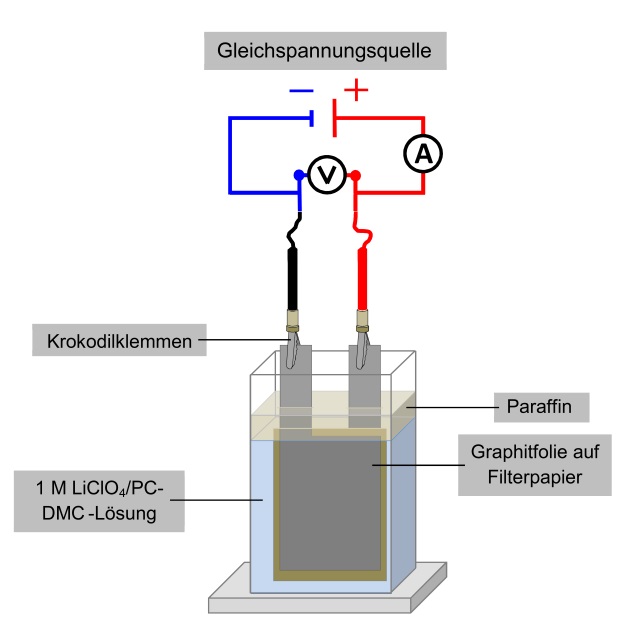
Kunststoffgefäß (8 cm x 4,5 cm x 2 cm), Bodenplatte, Filterpapier, Voltmeter, Amperemeter, Kabel, Krokodilklemmen, Trafo mit Gleichrichter, Elektromotor, Schere, Bleistift, Geodreieck, Klebepunkte, Magnetrührer, Graphitfolie
Chemikalien
Lithiumperchlorat, Propylencarbonat, Kohlensäuredimethylester, Paraffin (dünnflüssig)
Durchführung
a) Herstellung der Elektrolytlösung: Es wird ca. 1 M Elektrolyt-Lösung hergestellt, indem 4,25 g Lithiumperchlorat zu 60 mL eines Gemisches aus Propylencarbonat (16 mL) und Kohlensäuredimethylester (44 mL) hinzugegeben werden. Anschließend wird für ca. 15 min mit dem Magnetrührer gerührt, bis das Lithiumperchlorat vollständig gelöst ist.
b) Vorbereitung des Elektrodenmaterials: Zunächst werden zwei ca. 4 x 9 cm große Graphitfolienstücke zurechtgeschnitten und ein Rechteck der Größe 2,5 cm x 3 cm herausgeschnitten, damit zwei kleine Anschlusslaschen abstehen. Die Folienstücke werden anschließend mit zwei mittig positionierten Klebepunkten an die Vorder- und Rückseite eines Filterpapierstücks (4,5 cm x 7,5 cm) geklebt.
c) Erstellung des Lithium-Ionen-Akkus: Das vorbereitete Elektrodenmaterial wird in das Kunststoffgefäß gestellt und mit der Elektrolytlösung bis zur Oberkante des Filterpapiers befüllt. Anschließend muss die Elektrolytlösung mit einer 1 cm dicken Paraffinsicht überdeckt werden, um den Eintritt von Feuchtigkeit weitgehend zu unterdrücken.
Die beiden Graphitfolien werden als Plus- und Minus-Pol geschaltet und für ca. 3 Minuten bei einer Spannung von 4,5 V geladen. Nach dem Ladevorgang kann der Akkumulator mit einem Elektromotor verbunden werden. Es können mehrere Ladevorgänge durchgeführt werden.
Beobachtung
Der Akkumulator kann einen Elektromotor für ca. 5 min betreiben. Die Graphitfolie, die mit dem Minus-Pol verbunden ist, weist nach dem Aufladen eine veränderte Oberflächenstruktur auf.
Deutung
Durch das Laden werden am Minuspol Lithium-Ionen in die Graphitfolie und am Pluspol Perchlorat-Ionen in die Graphitfolie intercaliert. Diese Intercalation wird durch die Aufweitung des Elektrodenmaterials sichtbar. Dieses Phänomen wird Exfolation genannt. Nach Beendigung des Ladeprozesses und anschließen eines Elektromotors wandern die intercalierten Lithium-Ionen und Perchlorat-Ionen zurück in die Elektrolytlösung. Dies geschieht durch eine Redoxreaktion, bei der eine Spannung von maximal 4,5 V erzeugt werden kann.
Minuspol: Cn + xLi+ +xe- ⇄ Li+nCx+n (Hinreaktion: Laden, Rückreaktion: Entladen)
Pluspol: Cn + xClO4- ⇄ Cx+n(ClO4-)x + xe- (Hinreaktion: Laden, Rückreaktion: Entladen)
Beim Laden wird das Graphit am Minuspol durch Einlagern der Lithium-Ionen reduziert und am Pluspol durch Einlagerung der Perchlorat-Ionen oxidiert. Somit wird durch den Ladeprozess eine Anode (Pluspol) und Kathode (Minuspol) erzeugt. Bei dem Entladeprozess wird am Minuspol (nun Anode) das Graphit oxidiert indem die Lithium-Ionen deintercalieren und wieder in die Lösung gehen. Gleichzeitung wird am Pluspol (nun Kathode) aufgrund des Elektronenflusses das Graphit reduziert und die Perchlorat-Ionen deintercalieren in die Lösung.
Entsorgung
Die Lösungen werden im organischen Abfallbehälter entsorgt. Die Graphitelektroden werden mit Filterpapier für einen Tag ins Wasser gestellt und anschließend über den Hausmüll entsorgt.
Literatur
M. Oetken, M. Hasselmann, Lithium-Ionen-Akkumulator auf Basis redoxamphoterer Graphitintercalationselektroden, 2012, S. 22ff.
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.