| Thema: Batterien und Akkus | Tags: Zersetzungsspannung, Zinkhalogenide | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
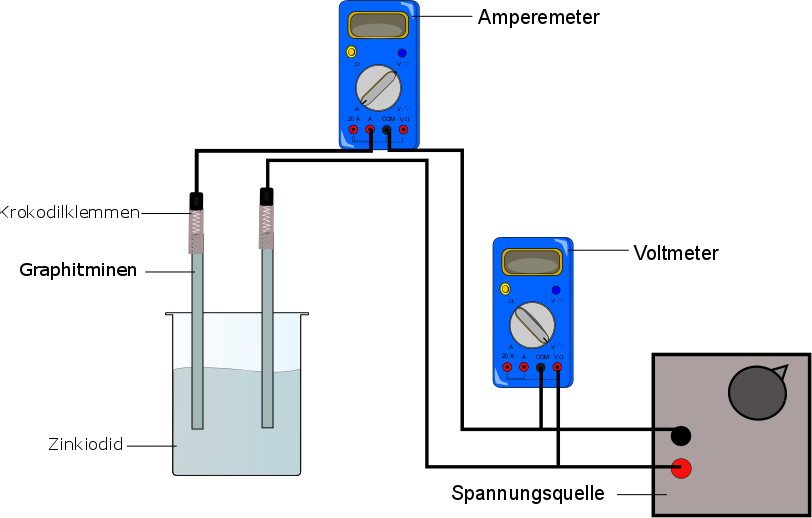
2 Graphitminen, 100 mL Glaskammer, Krokodilklemmen, Voltmeter, Amperemeter, Spannungsquelle
Chemikalien
Zinkbromid-Lösung 0,1 M
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Zinkbromid wasserfrei | H302-H314-H317-H411 | P273-P280-P305+P351+P338-P310 |    |
Durchführung
50 ml der Zinkbromidlösung werden angesetzt und in die Glaskammer gefüllt. Zwei Graphitminen (Bleistiftminen) werden mit Krokodilklemmen versehen und in die Glaskammer gestellt. Eine Stromquelle sowie ein Volt- und ein Amperemeter werden angeschlossen (Amperemeter in Reihe und Voltmeter als Parallelschaltung). Nun wird jeweils eine Spannung angelegt und in 0,5 V-Schritten erhöht. Dabei wird jeweils 30 Sekunden gewartet, bis die Spannung erhöht wird. Es wird beobachtet, ab wann sich eine Zersetzung einstellt. Die durch das System gebildete Spannung wird abgelesen, nachdem die Zersetzung stattgefunden hat und die Spannungsquelle ausgestellt worden ist.
Beobachtung
Bei ca. 2 Volt Spannung beginnt sich an einer Bleistiftmine ein braun-gelber Niederschlag zu bilden. Die andere Bleistiftmine verfärbt sich leicht weiß. Nach der Zersetzung kann eine Spannung von 1,9 V abgelesen werden.
Deutung
Beim Aufladeprozess handelt es sich um eine Elektrolyse. An der Kathode werden somit die Teilchen mit dem positivsten Potential reduziert und an der Anode werden die Teilchen mit dem negativsten Potential oxidiert.
| Anode/Oxidation: | 2 Br- → Br2 +2 e- | E0 = 1,07 V |
| 4 OH- → O2 + 2 H2O + 4 e- | E0 = 0,81 V | |
| Kathode/Reduktion: | Zn2+ + 2 e- → Zn | E0 = -0,76 V |
| 2 H3O+ + 2 e- → H2 + H2O | E0 = -0,42 V |
Demnach ergeben sich für die Zersetzungsspannungen von Wasser und Zinkbromid folgende Werte:
| Wasser: | E0 = 0,42 V + 0,81 V = 1,23 V |
| Zinkbromid: | E0 = 0,76 V + 1,07 V = 1,83 V |
Aufgrund dieser Potentiale müsste sich eigentlich Wasser in Wasserstoff und Sauerstoff zersetzen, was aufgrund der Überspannung dieser Gase an Graphit nicht erfolgt. Es kommt zur Abscheidung von Zink und Brom, was anhand eines silbergrauen Zink-Überzugs an der Kathode und einer gelb-braunen Brom-Abscheidung an der Anode deutlich erkennbar ist.
Entsorgung
Die Entsorgung erfolgt über den Halogen-Abfallbehälter.
Literatur
Praxis der Naturwissenschaften, „Aktuelle Entwicklungen in der Elektrochemie“, 8/64, 2015
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.