| Thema: Löslichkeits- und Ionenprodukt | Tags: pH-Wert, Löslichkeitsprodukt, Berechnung | Klassenstufen: 11-12 | Versuchsart: SV |
Materialien
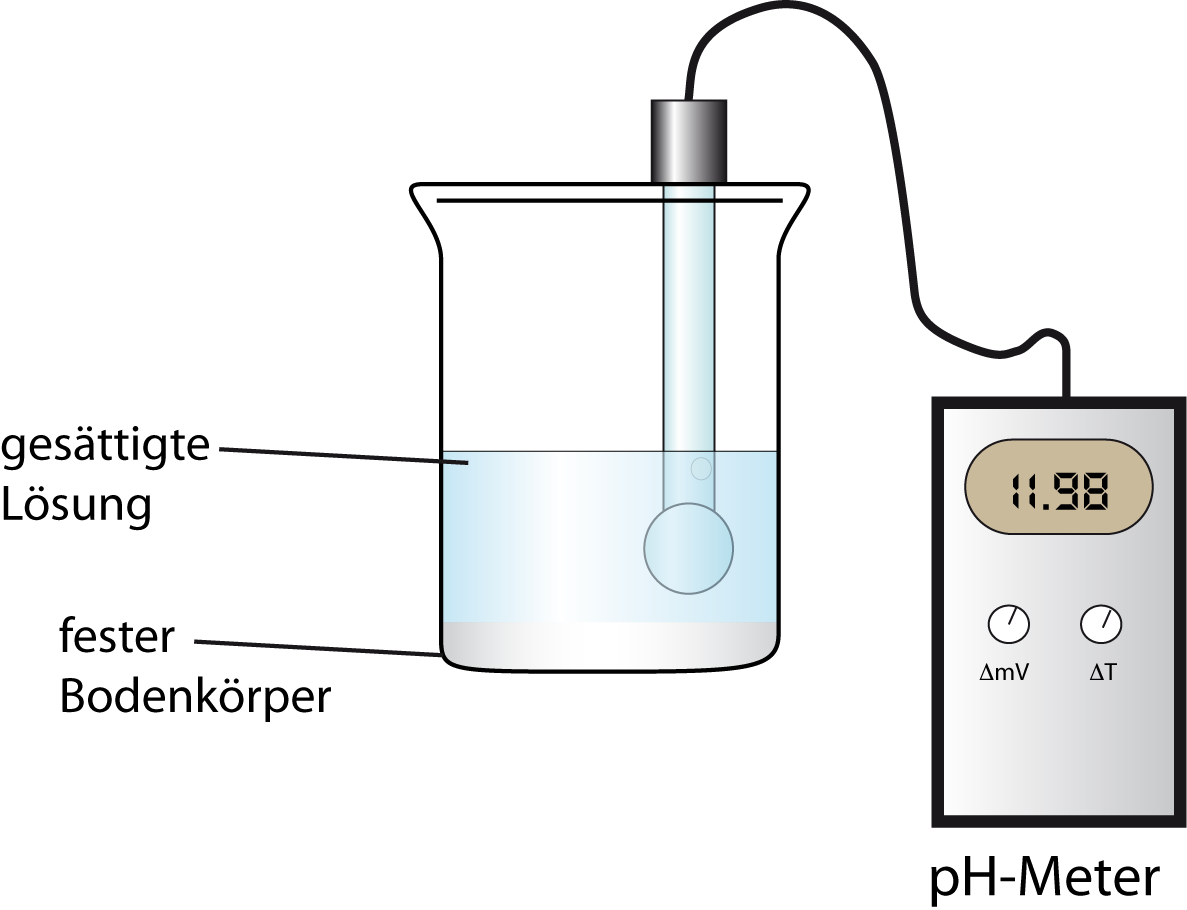
Becherglas (100 mL), pH-Meter
Chemikalien
Magnesiumhydroxid
Durchführung
Es wird eine gesättigte Magnesiumhydroxid-Lösung angesetzt. Anschließend wird der pH-Wert der Lösung gemessen.
Beobachtung
In der Lösung ist ein deutlicher Niederschlag zu erkennen. Der pH-Wert beträgt 10,35.
Deutung
Unter Einbeziehung der stöchiometrischen Beziehungen im Lösungsgleichgewicht der Hydroxide können die entsprechenden Löslichkeitsprodukte über den pH-Wert berechnet werden:
Mg(OH)2 (s) ⇌ Mg2+<(aq) + 2 OH-(aq)
| KL(Mg(OH)2) | = | [OH-]2 · [Mg2+] = [OH-]2 · 1/2 · [OH-] = 1/2 · [OH-]3 |
| [OH-] | = | 10-pOH = 10-(14 - pH) = 10-14 + 10,35 = 10-3,65 = 2,24 · 10-4 mol/L |
Es ergibt sich demnach:
KL(Mg(OH)2) = 1/2 · (2,24 · 10-4 mol/L)3 = 5,62 · 10-12 mol3/L3
Der Literaturwert liegt vergleichweise bei: 8,9 · 10-12 mol3/L3.
Entsorgung
Die Lösung kann im Abwasser entsorgt werden. Es muss mit viel Wasser nachgespült werden.
Literatur
R. Herbst-Irmer, Anorganisch-Chemisches Praktikum, Praktikumsskript 2013, Georg-August Universität Göttingen, S. 157.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.