| Thema: Brennbarkeit und Löslichkeit V | Tags: Löslichkeit, Temperaturabhängigkeit | Klassenstufen: 5-6 | Versuchsart: SV |
Materialien
Pinsel, schwarze Pappe, Föhn, ggf. Lupe, zwei Bechergläser (100 mL), Pasteurpipette, Glasstab, Spatel
Chemikalien
Natriumchlorid, Wasser
Durchführung
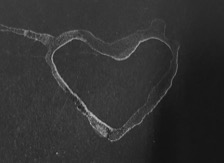
In ein Becherglas werden zu 50 mL Wasser 4 Spatellöffel Natriumchlorid gegeben, so dass eine übersättigte Salzlösung entsteht. Es wird einige Male mit einem Glasstab umgerührt. Mit einer Pasteurpipette wird die Salzlösung abgezogen und in ein zweites Becherglas gegeben. Der Bodensatz bleibt im ersten Becherglas zurück. Mit Hilfe eines Pinsels, der in die Salzlösung getaucht wird, wird ein Bild auf ein Stück schwarze Pappe gemalt. Dieses Bild muss ggf. mehrfach nachgezeichnet werden. Nach dem Auftragen auf die Pappe wird das Bild vorsichtig von oben trockengeföhnt. Dazu muss ein gewisser Abstand eingehalten werden, damit das Bild nicht aufgrund des Luftstroms verläuft. Das sich ergebende Bild kann zusätzlich mit einer Lupe betrachtet werden. [1]
Beobachtung
Auf der Pappe wird das gemalte Bild durch einen weißen Rückstand sichtbar. Außerdem sind mit bloßem Auge kleine Kristalle erkennbar.
Deutung
Fachwissenschaftliche Deutung
Wassermoleküle lagern sich an das Natriumchloridgitter an und lösen einzelne Ionen aus dem Ionengitter. Dieser Vorgang wird als Hydratation bezeichnet. Die Hydratation erfolgt aufgrund von elektrostatischen Kräften zwischen geladenen Ionen und den Dipolen der Wassermoleküle. Durch diese Ion-Dipol-Wechselwirkung entsteht die erste Hydrathülle um ein gelöstes Ion. Über Wasserstoffbrückenbindungen werden weitere Hydrathüllen gebildet.
Eine gesättigte Salzlösung enthält die maximale Menge des gelösten Salzes bei einer bestimmten Temperatur. Wird weiterhin Salz zugegeben, setzt sich dieses als Bodensatz ab. Dies wird als übersättigte Lösung bezeichnet. Ungesättigte Lösungen enthalten noch nicht die maximale Menge einer Substanz bei einer bestimmten Temperatur. Wenn weiterhin Substanz zugegeben wird, löst sich diese im Lösungsmittel und es entsteht kein Bodensatz. [2]
Durch die Verdampfung von Wasser kommt es zu einem Aggregatzustandswechsel. Das Wasser geht vom flüssigen in den gasförmigen Zustand über und strömt in die Umgebungsluft aus. Nach einiger Zeit bleiben lediglich die Chlorid- und Natriumionen im Becherglas zurück. Aufgrund der herrschenden Anziehungskräfte zwischen den Ionen bildet sich wieder ein Ionengitter und der Feststoff wird zurückgewonnen.
Didaktisch reduzierte Deutung
Durch das Föhnen des Bildes verdampft das Wasser der aufgetragenen Salzlösung. Sobald das Bild vollständig getrocknet ist, bleiben lediglich die Salzkristalle auf der Pappe zurück.
Entsorgung
Die restliche Lösung kann im Abfluss entsorgt werden. Die Pappe mit den Bildern kann im Hausmüll entsorgt werden.
Literatur
[1] unbekannter Autor, https://www.uni-oldenburg.de/fileadmin/user_upload/chemie/ag/didaktik/download/Stationen_gesamt.pdf, S.3 (zuletzt abgerufen am 18.07.2017, um 21:30 Uhr).
[2] Schubert, Prof. Dr. Volker et. al., http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/11/aac/vorlesung/kap_7/vlu/salzloesungen.vlu/Page/vsc/de/ch/11/aac/vorlesung/kap_7/kap7_5/kap7_52/kap7_52c.vscml.html (zuletzt abgerufen am 22.07.2017, um 12:50 Uhr).
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.