| Thema: Vom Erz zum Metall | Tags: Sauerstoffübertragung, exotherme Reaktion, Metallgewinnung | Klassenstufen: 7-8 | Versuchsart: SV |
Materialien
Feuerzeug, Bunsenbrenner, Reagenzglas mit durchbohrtem Stopfen, Spatel, Uhrglas, Becherglas, Glasrohr, Stativmaterial, Hexe, Mörser mit Pistill, Filterpapier, Trichter, Uhrglas
Chemikalien
schwarzes Kupferoxidpulver (Kupfer(II)-oxid), Holzkohlepulver, Bariumhydroxid, dest. Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Kupfer(II)-oxid | H302-H410 | P273-P301+P312 |   |
| Kohle gekörnt | -- | -- | |
| Bariumhydroxid-8-H2O | H302+H332-H314 | P280-P301+P330+P331-P304+P340-P309+P310 |   |
| Wasser | - | - |
Durchführung
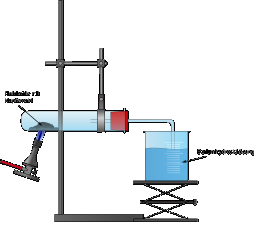
Der Versuchsaufbau erfolgt gemäß der Abbildung 1.
In einem Mörser werden 2 g schwarzes Kupferoxidpulver und 0,2 g trockenes Holzkohlepulver mit dem Pistill pulverisiert. Anschließend wird das Reaktionsgemisch mit Hilfe von Filterpapier in ein feuerfestes Reagenzglas gegeben. Nun wird eine Lösung aus 200 mL dest. Wasser und einer Spatelspitze Bariumhydroxid hergestellt (evtl. wird die Lösung filtriert, damit sie klar ist). Dieses wird mit einem durchbohrten Stopfen verschlossen. Das Reagenzglas wird mit einem Glasrohr verschlossen, der die entstehenden Gase in das Becherglas mit dem Bariumhydroxid leitet. Nun wird der Inhalt des Reagenzglas erhitzt, bis ein rötliches Glühen zu beobachten ist. Sofort nach Reaktionsende muss das Glasrohr aus der Bariumhydroxidlösung entfernt werden, um ein Übertreten des Reagenzglasinhalts in die Lösung zu verhindern. Das Reaktionsprodukt wird nach dem Abkühlen auf ein Uhrglas gegeben und betrachtet.
Beobachtung
Das Gemisch glüht orange-rot auf, auch wenn der Bunsenbrenner entfernt ist. Das entstehende Gas trübt die Bariumhydroxidlösung (bzw. das Kalkwasser). Nach dem Abkühlen ist ein schwarz-grauer Feststoff mit einem rötlichen Kügelchen im Reagenzglas erkennbar.

Deutung
Die Trübung der Bariumhydroxidlösung (bzw. des Kalkwassers) zeigt, dass Kohlenstoffdioxid entstanden ist, denn dieses Gas lässt sich mit Bariumhydroxid oder Kalkwasser nachweisen: Calciumhydroxid (aq) + Kohlenstoffdioxid (g) → Calciumcarbonat (s) + Wasser (aq) Ca(OH)2 (aq) + CO2 (g) → CaCO3 (s) + H2O (aq) Auch mit Bariumhydroxid lässt sich Kohlenstoffdioxid nachweisen: Bariumhydroxid (aq) + Kohlenstoffdioxid (g) → Bariumcarbonat (s) und Wasser (aq) Ba(OH)2 (aq) + CO2 (g) → BaCO3 (s) + H2O (aq) Die Reaktion zwischen Kupferoxid und Eisen verläuft exotherm, da Energie freigesetzt wird: Kupferoxid (fest) + Kohlenstoff (fest) → Kupfer (fest) + Kohlenstoffdioxid (gas) 2 CuO (s) + C (s) → 2 Cu (s) + CO2 (g) Das Kupferoxid wird reduziert (gibt Sauerstoff ab), der Kohlenstoff wird oxidiert (nimmt Sauerstoff auf). Bei dem rötlichen Pulver handelt es sich um Kupfer.
Entsorgung
Die Lösung wird neutralisiert und über das Abwasser entsorgt. Das Kupfer wird in den Schwermetallsammelbehälter gegeben.
Literatur
[1] S. Sommer, http://netexperimente.de/chemie/70.html, unbekannt (zuletzt abgerufen am 25.07.2013 um 20:32 Uhr)
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.