| Thema: Merkmale einer chemischen Reakton | Tags: Merkmale, chemische Reaktion, Siedetemperatur | Klassenstufen: 7-8 | Versuchsart: SV |
Materialien
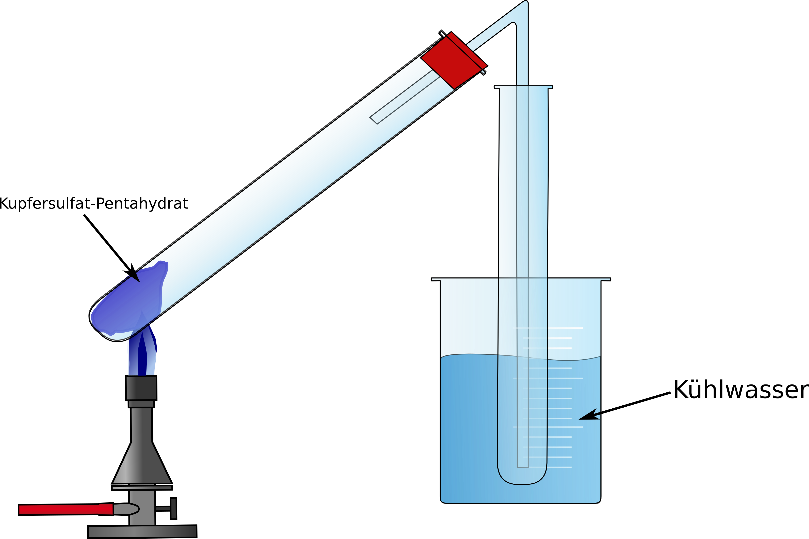
2 Reagenzgläser, Stativ, Bunsenbrenner, Becherglas, Stopfen mit Gasableitungsröhrchen, Eis
Chemikalien
Kupfer(II)-sulfat-Pentahydrat, Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Kupfer(II)-sulfat-5-H2O | H302-H319-H315-H410 | P280-P273-P302+P352-P305+P351+P338-P309+P311 |   |
| Kupfer(II)-sulfat wasserfrei | H302-H319-H315-H410 | -- |   |
Durchführung
Zunächst wird etwa 2 cm hoch blaues Kupfer(II)-sulfat-Pentahydrat in eines der Reagenzgläser gegeben. Das andere Reagenzglas wird in ein Becherglas mit Kühlwasser gegeben. Nun wird der Stopfen mit Gasableitungsröhrchen auf das Reagenzglas mit dem Kupfer(II)-sulfat-Pentahydrat gegeben und das Gasableitungsröhrchen in das andere Reagenzglas. Anschließend wird das Kupfer(II)-sulfat-Pentahydrat so lange vorsichtig erhitzt bis keine Dampfbildung mehr sichtbar ist.
Anschließend wird die Siedetemperatur der aufgefangenen Flüssigkeit im anderen Reagenzglas überprüft.
Zuletzt werden noch 2-3 Tropfen Wasser auf das abgekühlte Reaktionsprodukt gegeben.
Beobachtung
Beim Erhitzen entsteht ein Dampf und das vorher blaue Kupfer(II)-sulfat-Pentahydrat ändert seine Farbe zu weiß. Die aufgefangene Flüssigkeit hat eine Siedetemperatur von etwa 100°C. Wird Wasser auf das weiße Produkt gegeben, so verfärbt sich dieses wieder blau.
Deutung
Beim Erhitzen bildet sich Wasserdampf und das Wasser, welches in dem Kupfer(II)-sulfat-Pentahydrat gebunden ist, wird frei, es entsteht wasserfreies, weißes Kupfer(II)-sulfat. Somit handelt es sich bei der aufgefangenen Flüssigkeit um Wasser, welches anhand der Siedetemperatur von 100°C bestätigt werden kann. Wird nun wieder Wasser auf das weiße Kupfersulfat gegeben, entsteht das Kupfer(II)-sulfat-Pentahydrat, welches blau ist.
Entsorgung
Das Salz kann in den Behälter für Schwermetalle entsorgt werden, das Wasser im Abfluss.
Literatur
J. Hamm, http://www.hamm-chemie.de/k7/k7ab/merkmale_chem_reak.htm, 06.01.14 (zuletzt aufgerufen am 05.08.2015 um 22:50 Uhr)
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.