| Thema: Synthese, Analyse, Umsetzung | Tags: Synthesereaktion | Klassenstufen: 7-8 | Versuchsart: LV |
Materialien
Tropftrichter, 2-Hals Rundkolben (250 mL) Messpipette, Messzylinder, Schlauchmaterial, Standzylinder mit Sand gefüllt und Glasscheibe zum Abdichten, Stativ Klemmen, Winkelrohr, Bunsenbrenner, Tiegelzange
Chemikalien
Kaliumpermanganat, konz. Salzsäure, Chlorgas (entsteht durch Reaktion), Magnesiumband
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Kaliumpermanganat | H272-H302-H410 | -- |    |
| Salzsäure konz. | H314-H335 | -- |   |
| Chlor | H270-H331-H319-H335-H315-H400 | -- |     |
| Magnesium | H228-H261-H252 | -- |  |
| Magnesiumchlorid-6-H2O | -- | -- |
Durchführung
Da hier Chlorgas entsteht, muss unbedingt unter dem Abzug gearbeitet werden.
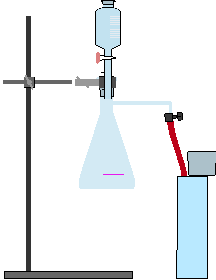
Es wird zunächst der Versuch nach unten stehendem Bild aufgebaut, ohne zunächst den Tropftrichter aufzusetzen. Dann werden 5 Spatellöffel Kaliumpermanganat in den Rundkolben gegeben und der der Tropftrichter aufgesetzt. Dieser wird nun mittels Messzylinder mit 30 mL konz. Salzsäure gefüllt. Anschließend wird das Winkelrohr in den leicht geöffneten Standzylinder geführt. Nun wird der Tropftrichter leicht aufgedreht, bis es zur Reaktion kommt und Gas aufgefangen wird. Anschließend wird das Magnesiumband im Bunsenbrenner zum Aufglühen gebracht und in den mit Gas gefüllten Standzylinder gegeben.
Beobachtung
Nach Öffnung des Tropftrichters ist sofort eine Gasentwicklung im Rundkolben sichtbar und wenige Augenblicke später im Standzylinder. Das Gas ist grüngelblich gefärbt. Nach dem Einwurf des Magnesiumbandes in den Standzylinder ist ein grelles Aufleuchten gefolgt von Rauchentwicklung sichtbar.
Deutung
Durch die Reaktion von Kaliumpermanganat und Salzsäure entsteht Chlorgas. Dieses reagiert mit Magnesium zu Magnesiumchlorid.
Herstellung von Chlor: 16 HCl(l) + 2 KMnO4(s) → 5 Cl2(g)↑ + 2 MnCl2(s) + 2 KCl(l) + 8 H2O(l)
Darauf folgt:: Cl2(g) + Mg(s) → MgCl2(s)
Entsorgung
Alle mit Chlorgas in Kontakt geratenen Gerätschaften werden unter den Abzug gelegt, um das Chlorgas abziehen zu lassen. Danach werden diese gereinigt. Reste des Reaktionsgemisches werden in Säure-Baseabfall gegeben.
Literatur
http://www.uni-koeln.de/math-nat- fak/didaktiken/chemie/material/fachdid_praktikum/49_herstellung_und_bleichwirkung_von_chlorgaswww.uni-koeln.de/math-nat-fak/didaktiken/chemie/material/fachdid_praktikumJ. Jentsch, 2009, aufgerufen am 6.8.2015
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.