| Thema: Salze und Salzbildung | Tags: Leitfähigkeitsmessung Salzlösung | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
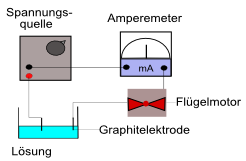
Stativ, Klemmen, Brenner, Amperemeter, Netzgeräte-Block, 2 Graphitelektroden, Flügelmotor, Becherglas (250 ml), Kabel
Chemikalien
Demineralisiertes Wasser, Natriumchlorid
Durchführung
Zwei Graphitelektroden werden mit Klemmen an zwei Stativen über einem Becherglas befestigt und mit den Gleichspannungs-Polen des Netzgerätes verbunden. Das Amperemeter und der Flügelmotor werden in Reihe in den Stromkreis eingebaut. Am Netzgerät wird eine Gleichspannung von ca. 4 V einstellen. Nun wird in das Becherglas erst demin. Wasser und danach eine Kochsalzlösung gefüllt, sodass die Graphitelektroden in die Lösungen tauchen. Der Flügelmotor und der Zeigerausschlag des Amperemeters werden jeweils beobachtet. Zu dem demin. Wasser wird sukzessiv Natriumchlorid (jeweils eine Spatelspitze) hinzugegeben und dabei werden der Zeigerausschlag des Amperemeters und der Flügelmotor beobachtet. Die Gleichspannung sollte nicht zu lange angelegt werden, da sonst eine Elektrolyse durchgeführt wird und Chlorgas entsteht. Es kann auch eine Wechselspannung angelegt werden, allerdings dreht sich der Flügelmotor nur bei einer angelegten Gleichspannung.
Beobachtung
Bei dem demin. Wasser ist keine Stromstärke zu messen und der Flügelmotor dreht sich nicht. Mit der Salzlösung im Becherglas ist eine Stromstärke zu messen. Nachdem ca. ein Spatel Salz zu dem demin. Wasser in das Becherglas gegeben wird, dreht sich zudem der Flügelmotor.
Deutung
Wenn Kochsalz in Wasser gelöst wird, dissoziiert es in Natrium- und Chlorid-Ionen. Sobald eine Spannung angelegt wird, wandern die Kationen (Natrium-Ionen) zum Minus-Pol und die Anionen (Chlorid-Ionen) zum Plus-Pol. Dadurch können Elektronen übertragen werden und die Lösung wird zu einem elektrischen Leiter. Je mehr Kochsalz-Ionen in der Lösung gelöst sind, desto besser leitet die Lösung den Strom. Demineralisiertes Wasser enthält keine Ionen, die Lösungen leiten den Strom deshalb nicht.
Entsorgung
Ausguss
Der Versuch kann als Problemexperiment eingesetzt werden, bei dem die SuS mit dem Konflikt konfrontiert werden, dass demineralisiertes Wasser Strom nicht leitet eine Salzlösung jedoch Strom leitet. Die SuS sollen mit Hilfe des Versuches darauf schließen, dass in der Salzlösung geladenen Teilchen vorliegen.
Weiterentwicklung:
Der Versuch kann mit Leitungswasser und einer Glukoselösung wiederholt werden, um auf die unterschiedlichen Bindungen zwischen Atomen im Zuckermolekül und in Salzen zu schließen.
Literatur
Blume, R., http://www.chemieunterricht.de/dc2/echemie/leitf2v.htm (Zuletzt abgerufen am 03.08.2013)
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.