| Thema: Titration | Tags: Säure, Base, Neutralisation | Klassenstufen: 9-10 | Versuchsart: LV |
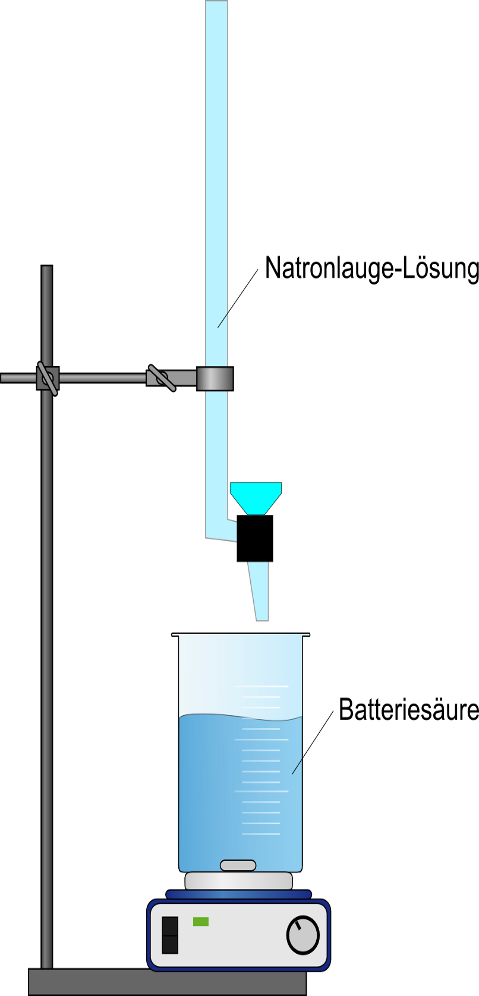
Materialien
10mL Messpipette, Peleusball, 100 mL Messkolben mit Stopfen, 20 mL Vollpipette, 300 mL Erlenmeyerkolben, Bürette, Waage, Magnetrührer, Rührstäbchen
Chemikalien
Batteriesäure (Schwefelsäure w = 37%), Natronlauge (0,1 M), Methylrot, dest. Wasser
Durchführung
1 mL Schwefelsäure wird in einen 100 mL Messkolben gegeben und die Einwaage bestimmt. Es wird bis zur Eichmarke mit dest. Wasser aufgefüllt, und geschüttelt, nachdem ein passender Stopfen aufgesetzt wurde. Davon werden 20 mL mit einer Vollpipette in einen Erlenmeyerkolben gegeben und mit dest. Wasser auf 100 mL aufgefüllt. 5-7 Tropfen der Methylrotlösung werden dazugegeben und mit Natronlauge bis zum Farbumschlag titriert.
Beobachtung
Die Einwaage von 1 mL Schwefelsäure entspricht einem Gewicht von 0,3 g.Nach Zugabe von 0,4 mL Natronlauge kommt es zum Farbumschlag von rot nach gelb. Aufgrund des geringen Verbrauchs sollte überlegt werden entweder eine Mikrobürette zu verwenden, oder die Konzentration der Natronlauge auf 1 mmol/L zu verringern.
Deutung
Beim Farbumschlag ist der Äquivalenzpunkt erreicht. Mittels der Einwaage und des Verbrauchs bis zum Farbumschlag lässt sich der Gehalt der Schwefelsäure bestimmen:
| β(H2SO4) = |
|
= |
|
= | 0,04 g/L |
Bei einem theoretischen Wert von 0,184 g/L ergeben sich folgende Fehler:
absoluter Fehler
∆absβ(H2SO4) = ∣ β(H2SO4)−Literaturwert ∣ = ∣ 0,04 g/L − 0,184 g/L ∣ = 0,144 g/L
relativer Fehler
| ∆relβ(H2SO4) = |
|
= |
| · 100 % | = |
| · 100 % | = | 78 % |
Die hohe Abweichung ist zum einen auf die Einwaage zurückzuführen. Hier liegt der theoretische Wert bei 1,84 g, wenn die Dichte herangezogen wird. Somit ist hier der größte Fehler auszumachen, der nur auf unsauberes Arbeiten zurückgeführt werden kann. Außerdem ist die Titration sehr ungenau, wenn berücksichtigt wird, dass das Endergebnis nahe dem Fehler der Apparatur liegt (± 0,1 mL).
Entsorgung
Die Lösung kann im Abfluss entsorgt werden.
Literatur
H. Keune & H. Böhland, Chemische Schulexperimente Bd. 3 – Algemeine, physikalische und analytische Chemie – Chemie und Umwelt, 2002, Volk und Wissen Verlag
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.