| Thema: Titration | Tags: Neutralisation, Säure, Base, Enthalpie | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
2 Bechergläser 250 mL, Bürette, Trichter, Thermometer, Magnetrührer + Rührfisch, 2 Uhrgläser
Chemikalien
Natronlauge (0,1 M), Salzsäure (0,1 M)
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Natronlauge 0,1 M | H314 | P280-P305+P351+P338-P310 |  |
| Salzsäure 0,1 M | H290 | -- |  |
Durchführung
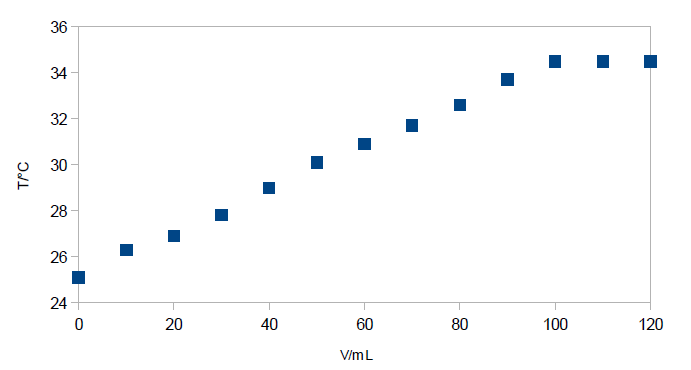
In eine 0,1 molare NaOH-Lösung wird ein Thermometer gegeben und zunächst die Anfangstemperatur gemessen. Nun wird eine 0,1 molare Salzsäure-Lösung in 10-mL-Schritten hinzugegeben und die Temperatur notiert. Es wird bis zur Zugabe von 120 mL Säure gemessen. Die Temperaturänderung ist graphisch darzustellen.
Beobachtung
Die klare Lösung wird wärmer und nach 100 mL Zugabe ändert sich die Temperatur nicht mehr.
| V in mL | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | 110 | 120 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T in °C | 25,1 | 26,2 | 26,9 | 27,8 | 29,0 | 30,1 | 30,9 | 31,7 | 32,6 | 33,7 | 34,5 | 34,5 | 34,5 |
| ΔT in °C | 0 | 1,2 | 0,6 | 0,9 | 1,2 | 1,1 | 0,8 | 0,8 | 0,9 | 1,1 | 0,8 | 0 | 0 |
Vergleiche hierfür Abb. 2.
Deutung
Bei der Neutralisation entsteht Wärme, die hier in Form der Temperaturänderung gemessen wird. Diese wird genutzt, um den Äquivalenzpunkt zu bestimmen. Bei weiterer Zugabe von Salzsäure findet keine Neutralisation mehr statt. Somit ändert sich in den letzten zwei Messschritten nichts. Wie es in der Auftragung oben zu erkennen ist, ist die Steigung ab V = 100 mL gleich Null und bleibt konstant. Somit ist der Äquivalenzpunkt bei V=100 mL erreicht.
H+(aq) + OH-(aq) → H2O(l) | ΔHNeutralisation = -55,4 kJ/mol
Entsorgung
Die Lösung kann in den Abfluss entsorgt werden.
Literatur
H. Keune & H. Böhland, Chemische Schulexperimente Bd. 3 – Allgemeine, physikalische und analytische Chemie – Chemie und Umwelt, 2002, Volk und Wissen Verlag
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.