| Thema: Titration | Tags: Leitfähigkeit, saurer Regen | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
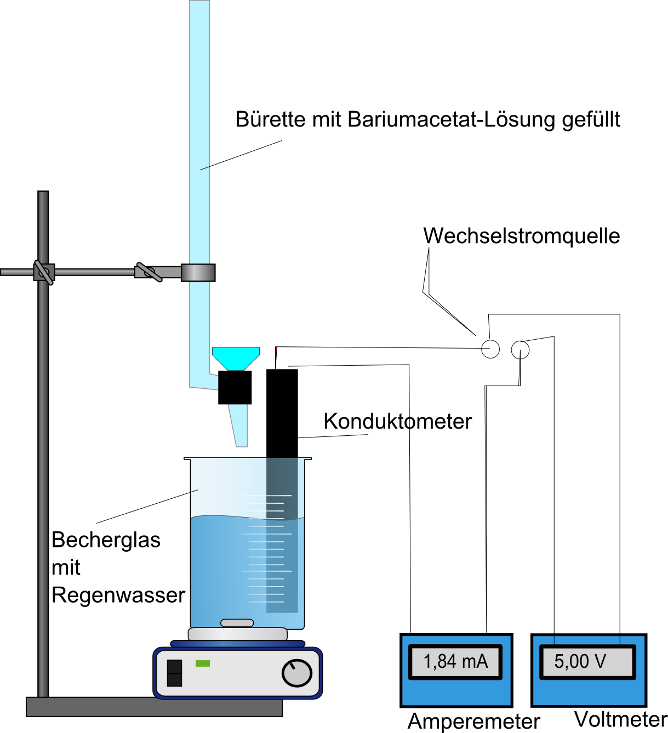
Konduktometer mit Leitfähigkeitsmesszelle, Mikrobürette, Magnetrührer, Rührstäbchen, 2 Bechergläser (800mL, 100 mL), Messzylinder (500 mL)
Chemikalien
Bariumacetatlösung (0,005 molar), Regenwasser
Durchführung
500 mL des Regenwassers werden im Becherglas auf 50 mL eingedampft und nach dem Abkühlen in ein 100 mL Becherglas umgefüllt. Die Spannung wird auf 5 V Wechselstrom eingestellt und konstant gehalten. Nun wird mit einer Bariumacetat-Lösung in 0,1-mL-Schritten titriert. Die Leitfähigkeit und das Volumen sind zu notieren.
Beobachtung
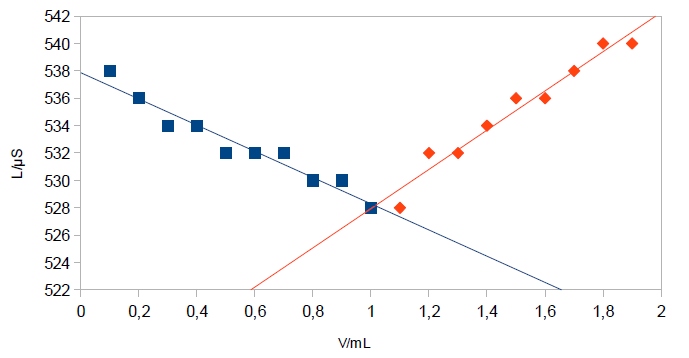
Somit ergeben sich folgende Werte für die Stromstärke in Abhängigkeit von der Bariumacetat-Zugabe. Daraus errechnet sich im selben Zug nach dem Ohm'schen Gesetz
R = U/I
und die Leitfähigkeit aus dem Kehrwert des Widerstandes R zu
L=1/R = I/U
| V in mL | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | 1,0 |
|---|---|---|---|---|---|---|---|---|---|---|
| I in mA | 2,69 | 2,68 | 2,67 | 2,67 | 2,66 | 2,66 | 2,66 | 2,65 | 2,65 | 2,64 |
| L in µS | 538 | 536 | 534 | 534 | 532 | 532 | 532 | 530 | 530 | 528 |
| V in mL | 1,1 | 1,2 | 1,3 | 1,4 | 1,5 | 1,6 | 1,7 | 1,8 | 1,9 |
|---|---|---|---|---|---|---|---|---|---|
| I in mA | 2,64 | 2,66 | 2,66 | 2,67 | 2,68 | 2,68 | 2,69 | 2,70 | 2,70 |
| L in µS | 528 | 532 | 532 | 534 | 536 | 536 | 538 | 540 | 540 |
Somit ergibt sich ein Schnittpunkt bei 1,01 mL Verbrauch an Bariumacetat-Lösung (vgl. Abb. 1).
Deutung
Am Umschlagspunkt, also an der Stelle, an der die Leitfähigkeit wieder steigt, findet sich der Äquivalenzpunkt. Über das verbrauchte Volumen lässt sich so die Konzentration des Sulfats bestimmen.
| β(SO42-) = |
| = |
| = |
| = | 0,97 mg/L |
Entsorgung
Die Lösung kann in den Abguss entsorgt werden.
Literatur
H. Keune & H. Böhland, Chemische Schulexperimente Bd. 3 – Algemeine, physikalische und analytische Chemie – Chemie und Umwelt, 2002, Volk und Wissen Verlag
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.