| Thema: PH-Wert | Tags: PH-Wert, Leitfähigkeit, Neutralisation, Natronlauge, Salzsäure | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
250 mL Becherglas, 2 Multimeter, Leitfähigkeitsprüfer, Trafo, pH-Meter, Magnetrührer, Bürette, Bürettenklammer, Stativmaterial
Chemikalien
NaOH(aq) (0.1 M), HCl(aq) (0.1 M)
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Natronlauge 0,1 M | H314 | P280-P305+P351+P338-P310 |  |
| Salzsäure 0,1 M | H290 | -- |  |
Durchführung
Die Bürette wird mit 50 mL Natronlauge gefüllt. Die Salzsäure wird in das Becherglas gegeben und auf den Magnetrührer gestellt. Das pH-Meter und der Leitfähigkeitsprüfer werden in das Stativ eingeklemmt und in die Lösung gestellt. Die Spannung wird auf 5 V gestellt und es wird Wechselstrom und -spannung mit dem Multimeter gemessen.
Der Magnetrüher wird auf eine mittlere Stufe gestellt und es wird Milliliterweise die Natronlauge in die Salzsäure titriert.
Beobachtung
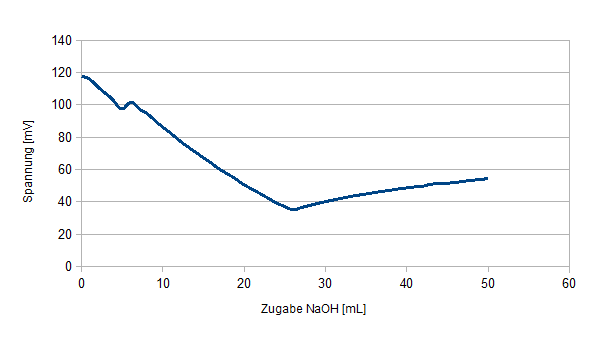
Der pH-Wert ändert sich nur sehr langsam bei Zugabe der Natronlauge. Die Spannung fällt zu Beginn der Titration jedoch recht schnell und später nur noch langsam. Nachdem 25 mL titriert wurden ändert sich der pH-Wert schlagartig und die Spannung steigt.
Deutung
Durch Zugabe von NaOH in die Salzsäure werden die H+ Ionen in der Lösung abgefangen und tragen nicht mehr zu Leitfähigkeit bei. Aus dem selben Grund sinkt auch der pH-Wert leicht. Da jedoch ein deutlicher Überschuss an Säure vorhanden ist ändert sich der pH-Wert nur leicht.
Am Äquivalenzpunkt ändert sich der pH-Wert schlagartig, da die OH- Konzentration die H+ Ionen Konzentration überschritten hat. Die Leitfähigkeit steigt in diesem Bereich nicht so stark, da Verdünnungseffekte eine Rolle spielen.
Literatur
http://www.ld-didactic.de/software/524221de/Content/ExperimentExamples/Chemistry/AnalyticalChemistry/TitrationHydrochloricAcid.htm Autor: nicht genannt. (Stand 05.08.13)
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.