| Thema: Titration | Tags: Säure-Base-Titration, PHYWE-Messung | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
Bürette mit Halterung, 100 mL Becherglas, Magnetrührer mit Rührmagnet, Stativ mit Klemme, Cobra 4 Wireless-Link mit Wireless Manager, pH-Elektrode (PHYWE GmbH), Computer mit Messsoftware measure
Chemikalien
Salzsäure, Natriumhydroxid, Wasser
Durchführung
Es werden jeweils eine 0,1 molare Salzsäure bzw. Natronlauge hergestellt. 20 mL der Salzsäure-Lösung wird in ein 100 mL Becherglas gegeben und auf den Magnetrührer gestellt. Die Bürette wird mit der Natronlauge aufgefüllt. In die Salzsäure wird die pH-Elektrode mit einer Stativklemme eingespannt und mit dem Cobra 4 Wireless-Link verbunden und eingeschaltet. Der Wireless-Manager wird über die USB-Buchse des Computers gesteckt und die Auswertungssoftware measure gestartet. Nachdem das Programm den Cobra 4 Wireless-Link mit der pH-Elektrode erkannt hat, kann die Messung starten. Es erfolgt die Titration unter ständigem Rühren. Die Messwerte werden nach jedem zugegebenen Milliliter Natronlauge gemessen, über Funk übertragen und direkt im Koordinatensystem des Messprogramms aufgetragen (pH gegen Messwert-Nummer).
Beobachtung
Anfangs liegt der pH-Wert im sauren Bereich (pH 1,2) und steigt nur sehr langsam an. Zwischen pH 5 – 6 steigt der Messwert sehr schnell an bis auf pH 10,3. Zum Abschluss kann der Äquivalenzpunkt in die Titrationskurve eingetragen werden und diese dann als Bitmap-Datei exportieren.
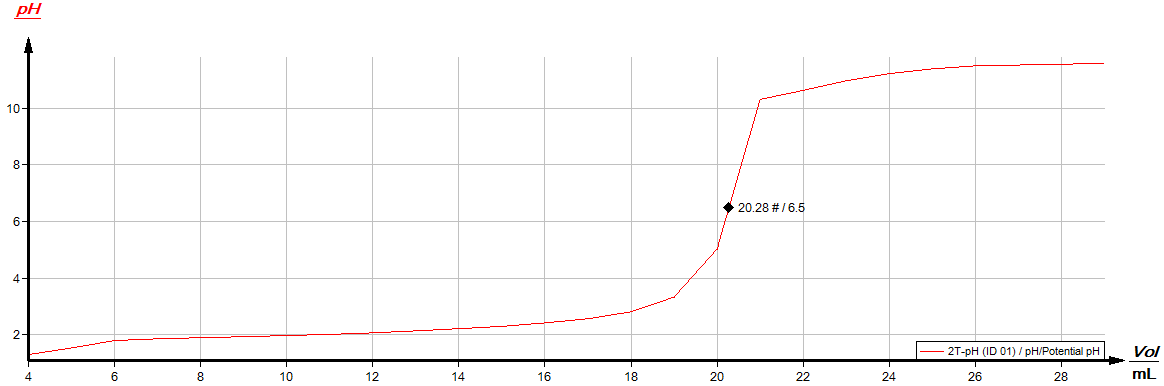
Deutung
Es findet eine Neutralisationsreaktion statt:
H+(aq) + OH-(aq) → H2O(l)
Am Äquivalenzpunkt kann über die bekannte Menge an Hydroxid-Ionen die Menge an Hydronium-Ionen und somit die Konzentration der Salzsäure ermittelt werden.
Entsorgung
Die Entsorgung erfolgt über den Säure-Base-Abfall.
Literatur
Northolz, M., & Herbst-Irmer, R. (2012). Skript zum anorganisch-chemischen Grundpraktikum für Lehramtskandidaten. Göttingen: Universität Göttingen.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.

