| Thema: Von Arrhenius zu Brönsted | Tags: Säure, Base, Indikator, Lavoisier | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
Brenner, großer Standzylinder, Verbrennungslöffel, Metalldeckel, Spatel
Chemikalien
destilliertes Wasser, Schwefel, Indikator (Universalindikator, Lackmus)
Durchführung
Gefahrenhinweis: Achtung! Im Abzug arbeiten!
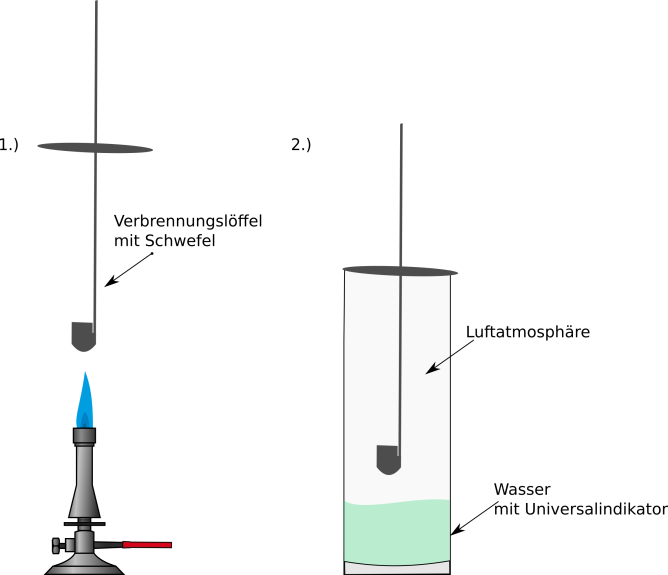
Vor dem Experiment glüht man zunächst den Verbrennungslöffel aus, um mögliche Rückstände zu entfernen. Man füllt einen Standzylinder ca. drei bis vier Zentimeter hoch mit Wasser und gibt drei Tropfen Universalindikator (alternativ auch Lackmus) zu. Der Verbrennungslöffel wird so an dem Metalldeckel befestig, dass er zu etwa zwei Drittel in Standzylinder reicht.
Nun wird der Verbrennungslöffel halbvoll mit Schwefel gefüllt. Im Abzug wird der Schwefel über dem Brenner mit rauschender Flamme entzündet und möglichst schnell in den Standzylinder gehängt.
Beobachtung
Der Schwefel verbrennt mit bläulicher Flamme. Weißlicher Nebel ist zu erkennen. Die wässrige Lösung mit dem Universalindikator färbt sich von grün nach rot. (Bei Verwendung von Lackmus als Indikator färbt sich die Lösung von violett zu rot.)
Deutung
Bei der Verbrennung von Schwefel entsteht Schwefeldioxid. Es bildet mit Wasser eine saure Lösung. Die Bildung der sauren Lösung kann man sich modellhaft wie folgt vorstellen:
SO2 (g) + H2O(l) → H2SO3 (aq)
Mit weiteren Wassermolekülen werden Oxoniumionen und zwei Arten von Säurerest-Ionen gebildet:
H2SO3 (aq) + H2O(l) → H2O+(aq) + HSO3-(aq)
HSO3-(aq) + H2O(l) → H2O+(aq) + SO32-(aq)
Die SO32-(aq)-Ionen werden als Sulfitionen bezeichnet, HSO3-(aq)-Ionen als Hydrogensulfitionen.
Entsorgung
Die entstandene schweflige Säure kann mit Natronlauge neutralisiert und im Anschluss im Abfluss entsorgt werden.
Dieser Versuch eignet sich sehr gut, um die Beobachtungen von Lavoisier zu bestätigen. Falls statt dem Universalindikator Lackmus verwendet wird, muss beachtet werden, dass Lackmus im Verdacht steht, eine krebserregende Wirkung zu haben, sodass dieses Experiment nur als Lehrerdemonstrationsexperiment durchgeführt werden sollte.
Die größte Schwierigkeit liegt in diesem Versuch darin, eine neutrale Lösung im Standzylinder vorzulegen, damit sich der Universalindikator grün färbt. Der Vorteil von Lackmus ist hierbei, dass er weniger empfindlich reagiert.
Literatur
W. Eisner, R. Fladt, P. Gietz, A. Justus, K. Laitenberger, W. Schierle, Elemente Chemie I – Unterrichtswerk für Gymnasium, Ernst Klett Verlag, 1986, S. 170.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.