| Thema: Von Arrhenius zu Brönsted | Tags: Starke und schwache Säuren,Dissoziation, Leitfähigkeit | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
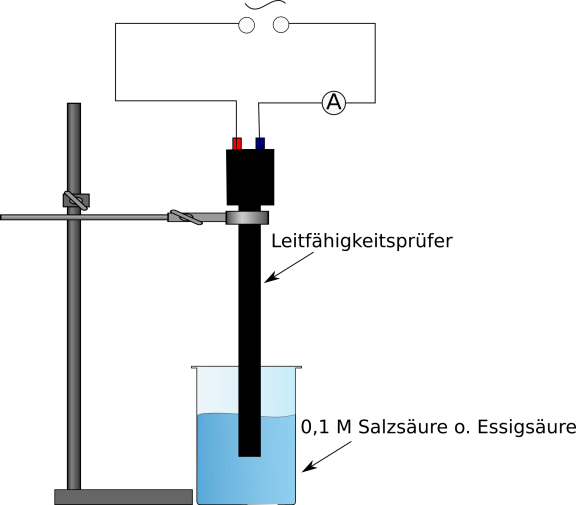
2 Multimeter, Kabel, Transformator, Leitfähigkeitsprüfer, Stativmaterial, 2 Bechergläser (100 mL), Becherglas (500 mL)
Chemikalien
destilliertes Wasser, 0,1 M Salzsäure, 0,1 M Essigsäure
Durchführung
Der Versuch wird gemäß Abb. 3 aufgebaut. Anschließend wird die elektrische Leitfähigkeit mittels Leitfähigkeitsprüfer gemessen, indem dieser in die Lösung getaucht wird. Währenddessen wird die gemessene elektrische Stromstärke bei 5 V Wechselspannung abgelesen.
Beobachtung
Die elektrische Stromstärke in 0,1 M Salzsäure beträgt 120 mA und in 0,1 M Essigsäure 30 mA.
Deutung
Essigsäure leitet den elektrischen Strom schlechter als Salzsäure trotz gleicher Konzentrationen.
Salzsäure ist eine starke Säure und dissoziiert in Wasser (nahezu) vollständig in Chlorid- und Hydronium-Ionen. Essigsäure als schwache Säure dissoziiert dagegen in Wasser nicht vollständig in Hydronium-Ionen und Acetat-Ionen und leitet somit den elektrischen Strom weniger gut. Des Weiteren ist das Acetat-Ion im Vergleich zum Chlorid-Ion größer und trägt somit durch größere Hinderung weniger zum Ionentransport (Leitfähigkeit) in der Lösung bei.
Entsorgung
Die Lösungen werden in den Abfallbehälter für Säuren und Basen entsorgt.
Dieser Versuch eignet sich sehr gut als Problemexperiment, da SuS intuitiv aus gleichen Konzentrationen auf gleiche Säurestärken schließen.
Des Weiteren könnte als Anschlussexperiment der pH-Wert der beiden sauren Lösungen gemessen werden, um den Begriff der Säurestärke quantitativ zu messen.
Literatur
W. Asselborn, M. Jäckel, K. T. Risch (Hrsg.), Chemie heute – Sekundarbereich I, Schroedel, 2001, S. 159.
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.