| Thema: Von Arrhenius zu Brönsted | Tags: Salmiak, Brönsted, Neutralisation | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
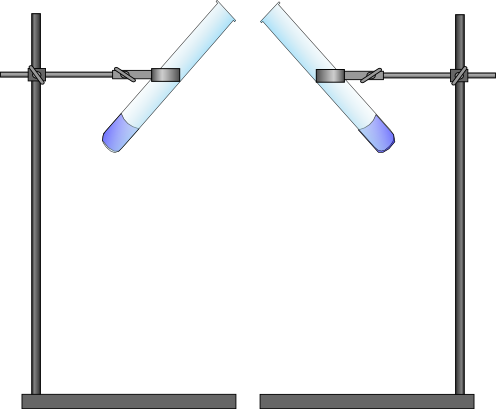
Stativmaterial, Reagenzgläser, Stopfen
Chemikalien
konzentrierte Salzsäure, konzentrierter Ammoniak
Durchführung
Achtung! Versuch im Abzug durchführen
Die Reagenzgläser werden mit jeweils 3 mL konz. Ammoniak oder 3 mL Salzsäure befüllt. Anschließend werden die Reagenzgläser mit den Öffnungen möglichst nah beieinander eingespannt.
Sobald eine Beobachtung erkennbar ist, wird tropfenweise Salzsäure zum Ammoniak gegeben.
Beobachtung
Im Verlauf der Reaktion ist eine Rauchentwicklung zu sehen.
Werden Salzsäure und Ammoniak zusammengegeben entsteht ein weißer Feststoff.
Deutung
Sowohl Ammoniak-Moleküle, als auch Chlorwasserstoff-Moleküle gehen teilweise in die Gasphase über. Sobald sie aus dem Reagenzglas diffundieren reagieren sie miteinander zu festem Ammoniumchlorid. Da kleine Partikel entstehen steigen diese weiter auf, wodurch Rauch sichtbar wird:
NH3(g) + HCl(g) → NH4Cl(s)
Wird Salzsäure-Lösung zu Ammoniak-Lösung getropft entsteht ebenfalls Ammoniumchlorid:
NH3(aq) + HCl(aq) → NH4Cl(s)
Dabei fungiert Ammoniak nach dem Säure-Base-Konzept von Brönsted als Protonenakzeptor und Chlorwasserstoff als Protonendonator.
Entsorgung
Der Feststoff kann in den Feststoffabfall gegeben werden.
Literatur
[1] H. Rheinholdt, Chemische Unterrichtsversuche, Springer-Verlag, 2013, S114f.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.