| Thema: Von Arrhenius zu Brönsted | Tags: Leitfähigkeit, Chlorwasserstoff, Arrhenius | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
Stativmaterial, Zwei-Hals-Rundkolben, Tropftrichter, Glasanschluss, Schlauchmaterial, Bechergläser, Glasspitze
Chemikalien
konz. Schwefelsäure, NaCl, Wasser, Aceton, Universalindikator
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Schwefelsäure konz. | H314 | -- |  |
| Aceton | H225-H319-H336-EUH066 | -- |   |
| Universalindikator 0-14 | -- | -- | |
| Natriumchlorid | -- | -- | |
| Salzsäure 1 M | H290-H315-H319-H335 | P261-P305+P351+P338 |   |
| Chlorwasserstoff | H331-H314 | -- |    |
Durchführung
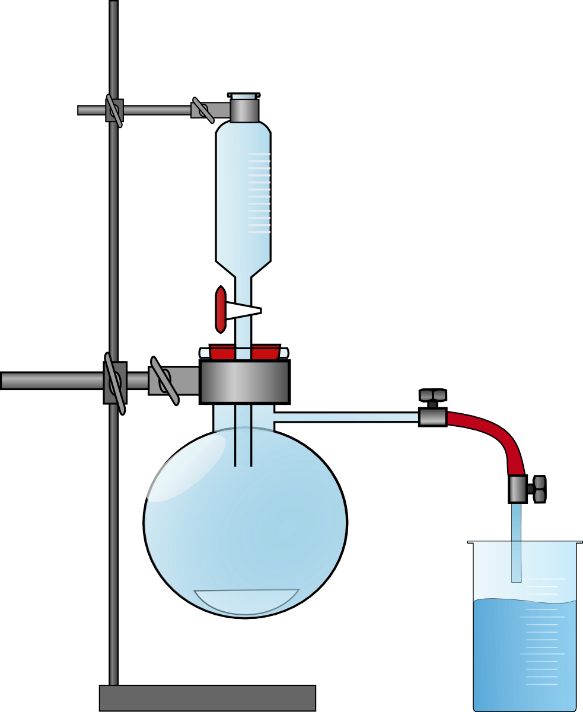
- Die Apparatur wird gemäß Abbildung 1 aufgebaut.Ein Leitfähigkeitsprüfer wird in dest. Wasser und in Aceton gehalten. Dabei wird sowohl die Stromstärke als auch die Spannung notiert.
- In den Rundkolben werden ca. 1,5 g NaCl gegeben, in den Tropftrichter etwa 8 mL konz. Schwefelsäure. Die Apparatur wird luftdicht verschlossen und ein Becherglas mit 25 mL Wasser befüllt, die Glasspitze wird knapp über der Oberfläche der Flüssigkeit eingespannt. Etwa 2 mL der konz. Schwefelsäure werden auf das NaCl gegeben. Sobald eine leichte Färbung des Indikators auftritt wird ein weiteres Becherglas mit Aceton gefüllt und mit dem ersten ausgetauscht. Anschließend werden nochmal 2-3 mL Schwefelsäure auf das NaCl getropft. Nach etwa 3 Minuten wird das Becherglas mit Aceton durch ein Becherglas mit Wasser ausgetauscht. So kann überschüssiges HCl-Gas aufgefangen werden. Die Stromstärke von dem Aceton-HCl-Gemisch wird gemessen und notiert.
- Anschließend werden etwa 25 mL Wasser zu dem Aceton gegeben, kurz gerührt und abermals gemessen.
Beobachtung
- Die gemessene Stromstärke bei dest. Wasser und bei Aceton beträgt 0,00 mA.
- Bei Zugabe der Schwefelsäure zu Natriumchlorid ist eine Gasentwicklung zu beobachten. Der Universalindikator färbt sich von gelb zu rot. Die gemessene Stromstärke beträgt etwa 50 mA. Die Stromstärke im Aceton-HCl-Gemisch beträgt 0,01 mA.
- Nach Zugabe von Wasser ist eine Stromstärke von etwa 20 mA abzulesen.
Deutung
Wird konz. Schwefelsäure zu dem NaCl gegeben, entsteht die stärkere Säure in Form des Chlorwasserstoffgases:
H2SO4 (aq) + NaCl(s) → NaHSO4 (aq) + HCl(g)
Dieses Gas löst sich anschließend in dem Wasser, wodurch eine saure Lösung entsteht.
HCl(g) + H2O(l) ⇌ H3O+(aq) + Cl-(aq)
Durch die freigesetzten Hydronium-Ionen färbt sich der Indikator schließlich rot. Die entstandenen Hydroniumionen sind für die hohe Leitfähigkeit der Lösung verantwortlich.
In Aceton dissoziiert der Chlorwasserstoff nicht, deshalb ist kein Stromfluss zu messen. Erst nach Zugabe von Wasser kann der Chlorwasserstoff dissoziieren und setzt Hydronium-Ionen frei, wodurch ein Stromfluss zu beobachten ist.
Mit Hilfe der Stromstärke und der Spannung kann der Leitwert der Lösung bestimmt werden:
G = 1/R = I/U
Daraus ergeben sich folgende Werte:
| Medium | U in V | I in mA | G in mS |
|---|---|---|---|
| dest. Wasser | 5,12 | 0,00 | 0 |
| Aceton | 5,09 | 0,00 | 0 |
| HCl-Lösung | 5,05 | 51,3 | 10,158 |
| Aceton + HCl | 5,10 | 0,01 | 0,002 |
| Aceton/Wasser + HCl | 5,07 | 22,9 | 4,516 |
Entsorgung
Sämtliche Säurelösungen werden zusammengegeben, neutralisiert und über den Abfluss entsorgt. Das Aceton-Wasser-Gemisch wird ebenfalls neutralisiert und in den Abfall für organische Lösungsmittel gegeben. NaCl- oder NaHSO4-Reste werden über den Feststoffabfall entsorgt.
Literatur
K. Freytag/V. Scharf, et al., Handbuch des Chemieunterrichts Sekundarbereich Band 4/I: Säuren – Basen/Laugen, 2008, S.114
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.