| Thema: Von Arrhenius zu Brönsted | Tags: Schwefel, Nichtmetalle, Kontaktverfahren, Lavoisier | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
Quarzrohr, durchbohrte Stopfen, Glasrohre, Waschflaschen, PVC-Schläuche, Wasserstrahlpumpe, Stativmaterialien, Tiegel in Schiffchenform, 2 Gasbrenner
Chemikalien
konz. Schwefelsäure, Mangan(IV)-oxid, dest. Wasser, Pyrit
Durchführung
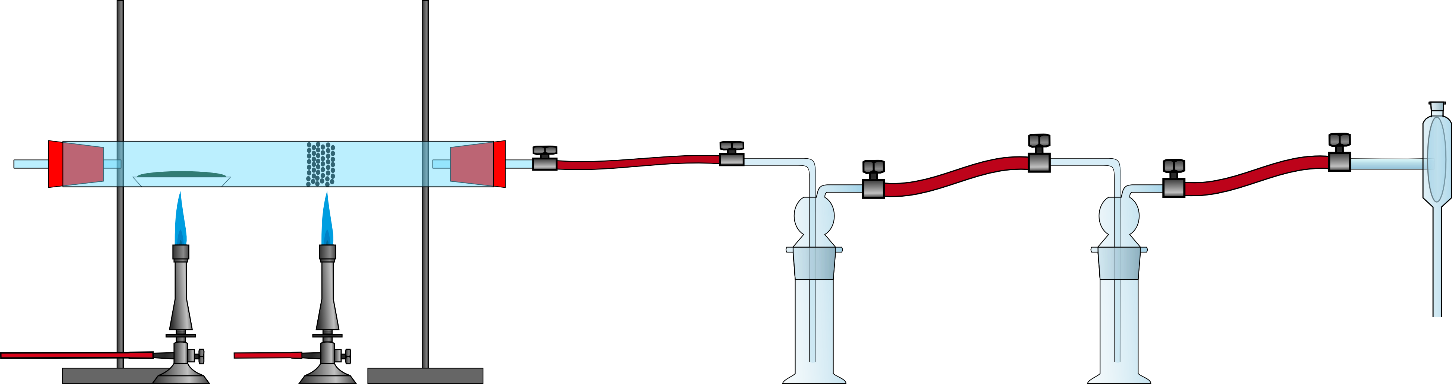
Etwa in der Mitte des Quarzrohres wird ein Stück Glaswolle platziert, die eine Seite wird mit etwa 10 g Mangan(IV)-oxid befüllt und mit einem weiteren Stück Glaswolle verschlossen. Das Glasrohr wird auf zwei Stativklemmen gelegt, aber nicht fest eingespannt. Der Pyrit wird auf einen Tiegel in Schiffchenform gegeben, dieser wird in der linken Seite des Quarzrohres platziert. Die Apparatur wird gemäß Abb.1aufgebaut. Anschließend werden der Pyrit und das Mangan(IV)-oxid bis zur Rotglut erhitzt. Sobald ein rotes Glühen auftritt, wird die Wasserstrahlpumpe geöffnet und eine Sogwirkung erzeugt. Dabei sollte eine Strömungsgeschwindigkeit von etwa 5-7 Bläschen pro Sekundein den Waschflaschen zu sehen sein.
Beobachtung
Die beiden Feststoffe glühen rot. Die Lösung der ersten Flasche färbt sich von gelb zu rot.
Deutung
Der Pyrit wird durch das Erhitzen oxidiert:
4 FeS2 (s) + 11 O2 (g) → 8 SO2 (g) + 2 Fe2O3 (s)
Durch das angeschlossene Vakuum wird das entstehende Schwefeldioxid durch die Versuchsapparatur gesogen. Das glühende Mangan(IV)-oxid dient als Katalysator für eine Oxidation des Schwefeldioxids zu Schwefeltrioxid:
2 SO2 (g) + O2 (g) → 2 SO3 (g)
Das Schwefeltrioxid löst sich in dem destillierten Wasser, bei dieser Reaktion entsteht Schwefelsäure:
SO3 (g) + H2O(l) → H2SO4 (aq)
Durch die Entstehung der Schwefelsäure und ihre Dissoziation werden H+-Ionen frei. Diese reagieren mit dem Indikator:
H+(aq) + Ind-(aq) (gelb) → HInd(aq) (rot)
Entsorgung
Die konzentrierte Schwefelsäure wird zusammen mit der selbsthergestellten Schwefelsäure in ein Gefäß gegeben und in diesem neutralisiert. Anschließend kann die neutrale Lösung über den Ausguss entsorgt werden. Das restliche Pyrit und das entstandene Eisen(III)-oxid werden in den Feststoffabfall gegeben, Mangan(IV)-oxid wird in verdünnter Salzsäure gelöst und anschließend in den Schwermetallabfall gegeben.
Literatur
K. Freytag/V. Scharf, et al., Handbuch des Chemieunterrichts Sekundarbereich Band 4/I: Säuren – Basen/Laugen, 2008, S.89
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.