| Thema: Vom Alkan zum Alkohol | Tags: Verbrennungsprodukte, Nachweis, Alkane | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
Gasbrenner, Stativ, Glastrichter, Schlauchstücke, Schlauchschellen, Hausvakuum (alterativ: Wasserstrahlpumpe), 500 ml Becherglas, Hexe, U-Rohr, Spatel
Chemikalien
Calciumhydroxid-Lösung, Kupfer(II)sulfat (wasserfrei), dest. Wasser, Eis
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Propan | H220 | -- |   |
| Kupfer(II)-sulfat wasserfrei | H302-H319-H315-H410 | -- |   |
| Kupfer(II)-sulfat-5-H2O | H302-H319-H315-H410 | P280-P273-P302+P352-P305+P351+P338-P309+P311 |   |
| Calciumhydroxid Pulver | H318 | P280-P305+P351+P338-P309+P310 |  |
| Calciumcarbonat | -- | -- |
Durchführung
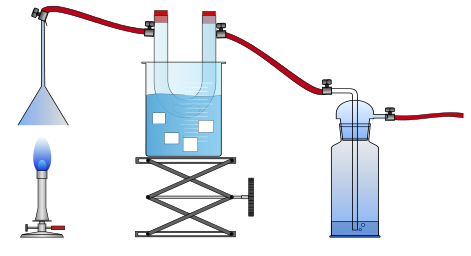
Ein umgekehrter Glastrichter wird mit einem gekühlten U-Rohr und einer Waschflasche durch Schläuche verbunden (siehe Abbildung 3). Die Waschflasche ist am Hausvakuum angeschlossen, alternativ kann aber auch eine Wasserstrahlpumpe verwendet werden. 2-3 Spatelspitzen des wasserfreien Kupfer(II)-sulfats werden in das U-Rohr gegeben. Eine Calciumhydroxid-Lösung wird in die Waschflasche gefüllt und der Gasbrenner wird mit kleiner Flamme unter den Trichter gestellt.
Beobachtung
Das weiße Kupfersulfat färbt sich bläulich und es bilden sich Tropfen einer farblosen Flüssigkeit an der Innenseite des U-Rohrs. Die Calciumhydroxid-Lösung trübt sich weiß.
Deutung
Bei der Verbrennung von Propan entstehen die Verbrennungsprodukte Kohlenstoffdioxid und Wasser. Diese werden durch das Hausvakuum durch die Apparatur geleitet. Alternativ kann auch mit einer Wasserstrahlpumpe Vakuum erzeugt werden, falls in der Schule kein Hausvakuum zur Verfügung steht. Das Hausvakuum wird benötigt, um die Verbrennungsprodukte effektiv durch die Apparatur zu leiten. Ohne Vakuum sind die Nachweisreaktionen kaum zu erkennen.
Kupfer(II)-sulfat reagiert mit Wasser zu Kupfer(II)-sulfat-Pentahydrat, welches eine blaue Färbung hat. Beim Einleiten von Kohlenstoffdioxid in Calciumhydroxid-Lösung bildet sich Calciumcarbonat als weißer Niederschlag. Das Entstehen eines Kupferkomplexes sollte in der 9./10. Jahrgangsstufe nicht thematisiert werden. Die Erklärung würde zu weit führen und eventuell Verständnisschwierigkeiten verursachen. Aus diesen Gründen müsste didaktisch reduziert werden. Es sollte nur auf die Farbveränderung eingegangen werden und nicht auf die Bildung des Kupferkomplexes.
Reaktionsgleichungen:
Verbrennung von Propan:
C3H8 (g) + O2 (g) → 3 CO2 (g) + 4 H2O(l)
Komplexbildung bei der Reaktion von entstandenem Wasser mit Kupfer(II)-sulfat:
CuSO4 (s) + 5 H2O(l) → [Cu(H2O)4]SO4 · H2O(aq)
Ausfällen von Calciumcarbonat aus Calciumhydroxidlösung mit entstandenem Kohlenstoffdioxid:
Ca(OH)2 (aq) + CO2 (g) → CaCO3 (s) ↓ + H2O(l)
Entsorgung
Nicht brennbare Gase im Abzug entsorgen. Reste brennbarer Gase vorsichtig im Abzug abbrennen. Kupfer(II)-sulfat kann im anorganischen Abfall mit Schwermetallen entsorgt werden. Calciumcarbonat kann im Abfluss entsorgt werden.
Literatur
Seilnacht, T. http://www.seilnacht.com/Lexikon/orgkohl.html
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.