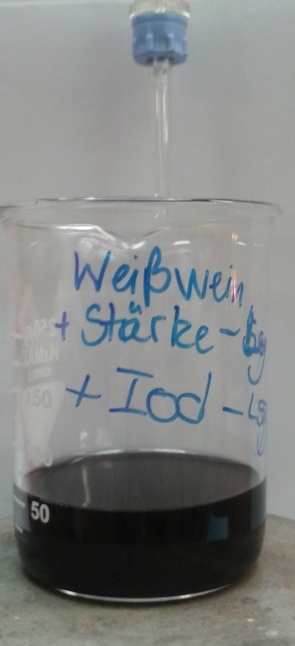| Thema: Titrationen (Alltagschemikalien) | Tags: Redox-Titration | Klassenstufen: 9-10 | Versuchsart: LV |
Materialien
Bürette, Trichter, Becherglas (500 mL), Magnetrührer, Pipette, Peleusball, 2 Bechergläser (100 mL), Bergerglas (250 mL), Stativ, Muffe
Chemikalien
Iodlösung (Kaliumiodid und Iod 0,05 M), Stärkelösung, Weißwein, Natriumthiosulfat-Lösung (0,05 M)
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Kaliumiodid | H302-H315-H319 | P305+P351+P338 |  |
| Iod | H332-H312-H400 | -- |   |
| Natriumthiosulfat-5-H2O | -- | -- | |
| Stärke löslich | -- | -- |
Durchführung
Es werden 50 mL Weißwein in das Becherglas gegeben. Dazu werden 10 mL der Iodlösung und 2-3 mL Stärkelösung gegeben und gut durchmischt. Anschließend wird mit Natriumthiosulfat bis zur Entfärbung titriert.
Beobachtung
Bei der Zugabe der Stärkelösung zu dem Weißwein-Iodwasser-Gemisch zeigt die Lösung eine dunkelblaue bis schwarze Färbung. Nach einem Verbrauch von 9,5 mL der Thiosulfatlösung ist die Lösung vollständig entfärbt (siehe
Deutung
Die dunkle Färbung des Weißwein-Iodwasser-Stärkegemisch ist durch die Bildung des farbigen Iod-Stärke-Komplexes bedingt. Dieser zeigt eine dunkelblaue bis schwarze Färbung auf. Iod liegt im Überschuss vor und wird mit der Natriumthiosulfatlösung oxidiert um auf die im Iod-Stärke-Komplex gebundenen Ionen zurückschließen zu können. Dieser Vorgang führt zu der Entfärbung des Gemisches. Folgende Reaktionen laufen ab.:
SO32-(aq) + 3 H2O(l) + I2(aq) ⇌ SO42-(aq) + 2H3O+(aq) + 2 I-(aq) (1)
Das Sulfit ist im Weißwein enthalten, um zu verhindern, dass Weine nachgären und zu Essig werden. Bei dieser Reaktion findet eine Oxidation des Sulfits zu Sulfat statt.
Die Reaktion der Rücktitration vom Iod im Überschuss mit Thiosulfat sieht wie folgt aus:
2 S2O32-(aq) + I2(aq) ⇌ S4O62-(aq) + 2 I-(aq) (2)
Aus der Reaktionsgleichung (2) ist nun das Stoffmengenverhältnis von Iod zu Thiosulfat ersichtlich. Zudem liegen äquimolare Lösungen von Titrand und Titrator vor, sodass Stoffmenge und Volumen äquivalent verwendet werden können.
Es ist: n(I2) : n(S2O32-) = 1:2, d.h. 1 mL Thioslufatlösung zeigt 0,5 mL unverbrauchte Iod-Lösung an. Nun können Berechnungen zum Sulfitgehalt im Weißwein folgen:
V(S2O32-) = 9,5 mL, also V(I2) = 4,75 mL.
Damit ergibt sich der Verbrauch der Iodlösung für die Oxidation von Sulfit zu Sulfat:
10 mL - 4,75 mL = 5,35 mL.
Die 10 mL sind das Gesamtvolumen der eingesetzten Iodlösung.
n(I2 Verbrauch) = c · V = 0,05 mol/L · 5,25 · 10-3 L = 2,625 · 10-4 mol
Aus der Reaktionsgleichung (1) ist es möglich das Stoffmengenverhältnis von Iod zu Sulfit abzulesen, dies ist
n(I2) : n(SO32-) = 1 : 1
d.h. in der Probe waren 2,625 · 10-4 mol Sulfitionen enthalten. Letztendlich kann nun die Konzentration der Sulfitionen berechnet werden und mit den Höchstmengenangaben verglichen werden. Dabei ist zu beachten, dass Iod nicht nur das im Wein enthaltene Sulfit oxidiert, sondern auch den enthaltenen Zucker genauso wie das Ethanol zu Ethanal. Die Sulfite werden dem Wein beigemischt um diese Oxidation des Alkohols zu verhindern und den Wein dadurch länger haltbar zu machen. Wird das Sulfit nun oxidiert, wird die Oxidation des Alkohols nicht mehr gehemmt und durch das überschüssige Iod geschehen.
| c(SO32-) = |
|
= |
|
= | 5,25 · 10-3 mol/L | = | 5,25 mmol/L |
Dementsprechend kann die Massenkonzentration von Sulfit abgeleitet werden. Die molare Masse von Sulfit beträgt näherungsweise 80 g/mol.
m(SO32-) = c · M = 5,25 · 10-3 mol/L · 80 g/mol = 0,42 g/L = 420 mg/L
Der Höchstgehalt, der an Sulfiten im Weißwein enthalten sein darf, liegt bei 200 mg/L[1]. Wird dieser Wert mit dem errechneten, ist auffällig, dass der bestimmte Wert deutlich über dem erlaubten Wert liegt. Dies kommt zustande, da die Konzentration aller Substanzen die Iod reduzieren bestimmt werden.[2] Iod oxidiert die weiteren Bestandteile des Weins, wie Zucker und Ethanol, so dass der erhaltene Wert über dem Grenzwert liegt.
Entsorgung
Nach der Neutralisation mit Thiosulfat-Lösung, um sicherzustellen, dass das ganze Iod zu den Halogeniden reduziert wurde, wird das Gemisch nach der Neutralisation mit Natriumhydrogencarbonat ins Abwasser gegeben.
Literatur
[1] Rindchen´s Weinkontor GmbH & Co. KG, https://www.rindchen.de/sulfite-im-wein.html, 31.07.16 (Zuletzt abgerufen am 31.07.16 um 9:46 Uhr). [2] http://chemiefachberater.manosdresden.de/downloads/sulfitgehaltimwein.pdf, 31.07.16 (Zuletzt abgerufen am 31.07. 9:48Uhr).
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.