| Thema: Ester und Ether | Tags: Diethylether, Gefahr, Peroxide, Redoxreaktionen | Klassenstufen: 11-12 | Versuchsart: SV |
Materialien
Reagenzglas, Stopfen
Chemikalien
Dimethylether, Kaliumiodid, Konz. Salzsäure, Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Diethylether | H224-H302-H336-EUH019-EUH066 | -- |   |
| Kaliumiodid | H302-H315-H319 | P305+P351+P338 |  |
| Salzsäure konz. | H314-H335 | -- |   |
Durchführung
0,5 g Kaliumiodid, 1 mL konz. Salzsäure, 3 mL Wasser und 3 mL Diethylether werden in ein Reagenzglas gegeben. Das Reagenzglas wird mit einem Stopfen verschlossen und die Lösung wird geschüttelt. Das Reagenzglas wird in ein Stativ gespannt und über fünf Minuten beobachtet.
Beobachtung
Wenn in dem Diethylether Peroxide vorhanden sind, färbt sich die obere Phase gelb. Je stärker die Farbe der oberen Phase ins Violette übergeht, desto mehr Peroxide sind vorhanden.
Deutung
Kaliumiodid und Salzsäure dissoziieren in Wasser.
KI(s) + Cl-(aq) + H+(aq) → K+(aq) + Cl-(aq) + H+(aq) + I-(aq)
Die Peroxide oxidieren die Iodidionen in sauer Lösung zu Iod:
C2H5-O-O-C2H5 + 2 H+(aq) + 2 I-(aq) → C2H5-O-C2H5 + I2(aq) + H2O(l)
Das elementare Iod ist für die gelbe bzw. violette Färbung verantwortlich.
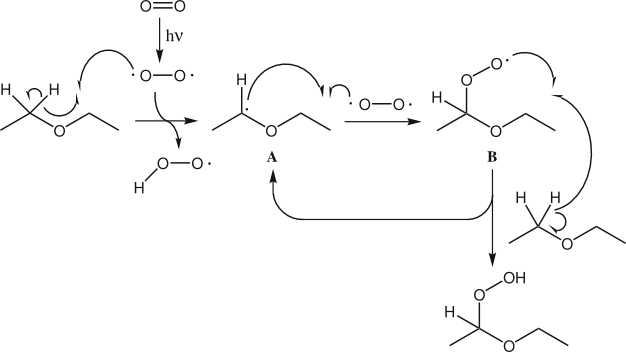
Die Peroxide entstehen aus Ethern nach folgendem Mechanismus (vgl. Abb. 2).
Entsorgung
Die Lösung wird mit Natriumthioslfat-Lösung versetzt und mit Natriumhydrogencarbonat neutralisiert. Anschließend kann sie über das Abwasser entsorgt werden.
Der Versuch verdeutlicht die Gefahr, die von Diethylether ausgeht, vor allem, wenn dieser über längeren Zeitraum gelagert wird. Zusätzlich zu diesem Versuch kann der Versuch V2 genutzt werden, in dem ein Ether-Luft-Gemisch zur Explosion gebracht werden.
Mit Hilfe des Versuches kann zum einen die Redoxreaktion und zum anderen radikalische Kettenreaktionen wiederholt werden.
Literatur
[1] extremchmiker, http://illumina-chemie.de/peroxide-in-ethern-t776.html, zuletzt abgerufen am 7.8.2013, 14.33 Uhr
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.