| Thema: Quantitative Analyse von Kohlenwasserstoffen II | Tags: Molare Masse, Grafische Auftragung | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
Gaswägekugel, Stopfen, Feinwaage
Chemikalien
Butan, Kohlenstoffdioxid, Stickstoff, Sauerstoff, Helium
Durchführung
Jedes Gas wird nacheinander in die Gaswägekugel gefüllt und gewogen. Das genaue Gewicht wird notiert.
Beobachtung
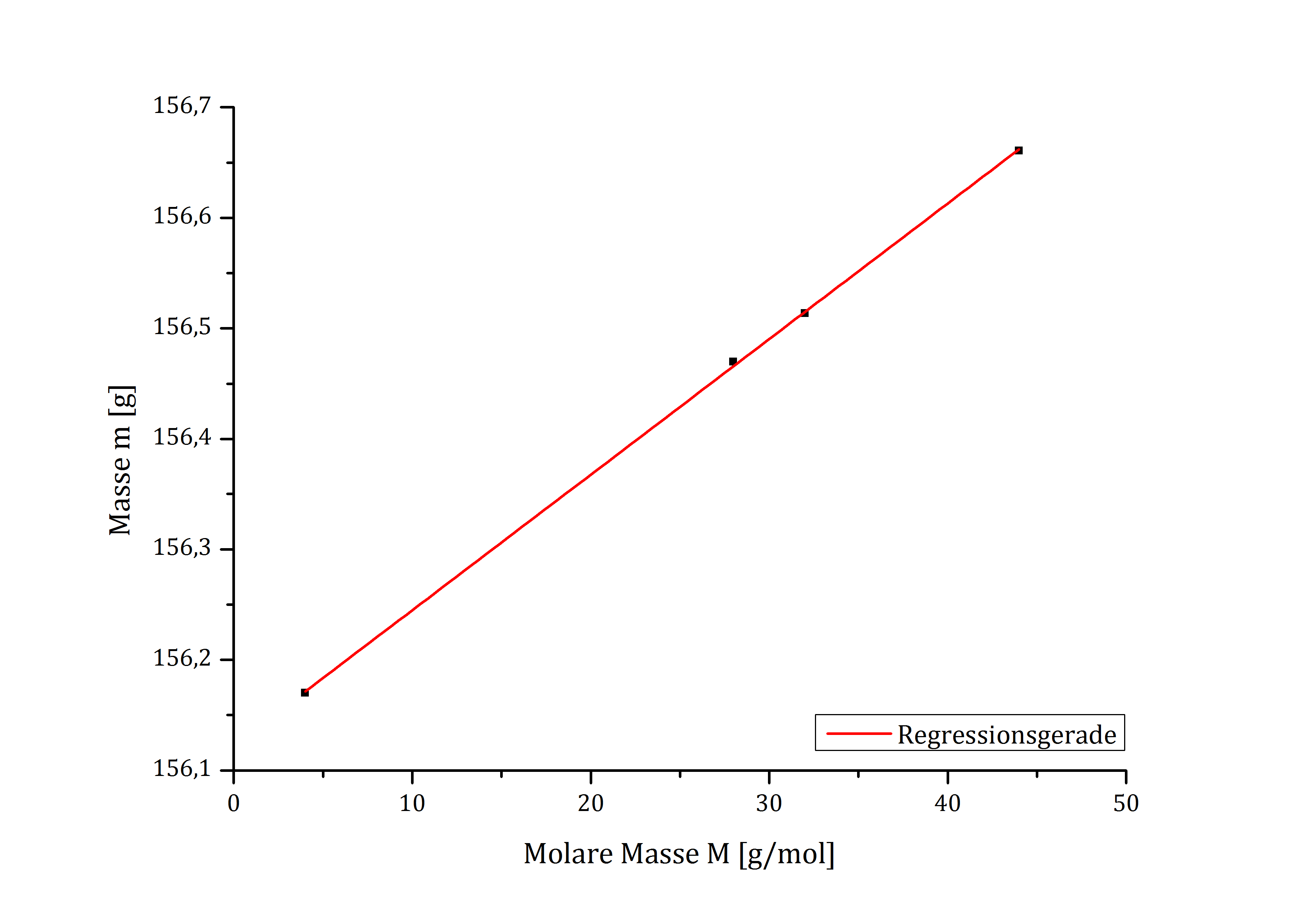
Die molaren Massen von CO2, N2, H2 und O2 sind bekannt, woraus sich folgende Tabelle ergibt:
| Masse m [g] | Molare Masse M [g/mol] | |
|---|---|---|
| Stickstoff | 156,4697 | 28,014 |
| Helium | 156,4697 | 4 |
| Sauerstoff | 156,5135 | 31,998 |
| Kohlenstoffdioxid | 156,6606 | 44,01 |
| Butan | 156,7919 | x |
Aus den bekannten Werten lässt sich folgende Grafik (vgl. Abb. 1)
Deutung
Die durch das Programm Origin erstellte Geradengleichung lautet wie folgt:
y = 0,01227x + 156,12221
Durch Einsetzen der gewogenen Masse des Kohlenwasserstoffs ergibt sich folgender Wert:
x = (156,7919 g - 156,12221)/0,01227 mol = 54,58 g/mol
Durch die ausgerechnete molare Masse des Kohlenwasserstoffs lässt sich auf Butan, mit einer molaren Masse von 58,12 g/mol schließen.
Fehlerbetrachtung:
Der leicht abweichende Wert von dem der Literatur ist darauf zurückzuführen, dass die Gaswägekugel nicht immer komplett mit dem jeweiligen Gas befüllt wurde.
Entsorgung
Die Gase können unter dem Abzug entsorgt werden.
Falls keine Feinwaage vorhanden ist kann auch mit einer Grobwaage gearbeitet werden. In diesem Fall ist es sinnvoll einen 1L-Kolben mit Stopfen (auch falls es keine Gaswägekugel gibt) zu verwenden, um genauere Ergebnisse zu erzielen. Grobwaagen haben nur eine oder zwei Nachkommastellen und durch die größere Masse des mit Gas befüllten Kolbens können Messfehler verringert werden.
Statt mit dem Programm Origin kann man Grafik auch mit Excel oder per Hand erstellen, um den fehlenden Wert zu berechnen.
Literatur
[1] W. Glöckner, W. Jansen, R. G. Weissenhorn (Hrsg.), Handbuch der experimentellen Chemie – Sekundarstufe II, Band 9: Kohlenwasserstoffe, Alius Verlag Deubner, 2005, S. 61-63
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.