| Thema: Quantitative Analyse von Kohlenwasserstoffen II | Tags: Ideales Gas, Dichte, Molare Masse | Klassenstufen: 11-12 | Versuchsart: lV |
Materialien
Einhalsrundkolben mit Schliff, Kolbenprober, Olive, Schlauchverbindung, Wasserbad, Heizplatte, Stativ, Stativmaterial, Pipette, Peleusball
Chemikalien
n-Pentan, Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| n-Pentan | H225-H304-H336-H411-EUH066 | -- |     |
Durchführung
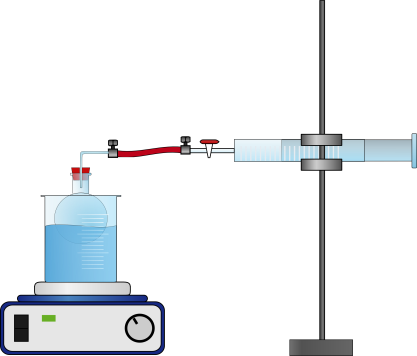
In einen Einhalsrundkolben werden 3 mL n-Pentan gegeben und gemäß Abbildung 4 mit dem Kolbenprober verbunden. Mit einem Wasserbad wird das n-Pentan zum sieden gebracht und solange gewartet, bis keine Volumenveränderung im Kolben mehr zu beobachten ist. Dieses sowie die Temperatur des Wasserbades werden notiert.
Kolbenprober nie vertikal am Stativ einspannen, da es sich um ein Feinschliffgerät handelt und aus diesem Grund leicht zerbrechlich ist! Zudem würde dem entstehenden Gas das Eigengewicht des Stempels entgegenwirken, was zu Messfehlern führen würde. Der Versuch ist unter dem Abzug durchzuführen!
Beobachtung
Es kommt zu einer Volumenveränderung von 65 mL. Die Temperatur im Wasserbad beträgt 60 °C.
Deutung
Der Siedepunkt von n-Pentan liegt bei 36,15 °C. Der Stempel des Kolbenprobers wird durch das zunehmende Volumen in der Gasphase herausgedrückt.
Zunächst lässt sich über das in den Kolben gegebene Volumen des flüssigen n-Pentans und seiner Dichte seine Masse berechnen:
p = m/V
m = p · V = 0,626 g/mL · 3 mL = 0,1878 g
Aus dem idealen Gasgesetzt ergibt sich folgender Zusammenhang:
p · V = n · R · T
n = m/M
p · V = (m/M) · R · T
M = (m · R · T)/(p · V)
Es wird angenommen, dass Normaldruck herrscht, weshalb p = 100 kPa. Für die Temperatur wird jene, die im Wasserbad gemessen wurde angegeben. R ist die ideale Gaskonstante.
M = (0,1878 g · 8,3144 kPa·L-1·K-1 · 333,15 K)/(100 kPa · 0,065 L)
M =80,03 g/mol
Die molare Masse von n-Pentan beträgt 72,15 g/mol. Der errechnete Wert weicht ca. 10 % von diesem ab.
Fehlerbetrachtung:
Die Abweichung kann dadurch zustande gekommen sein, dass nicht lange genug gewartet wurde und das n-Pentan nicht vollständig verdampft ist. Zudem ist es möglich, dass ein Teil im Kolben bereits wieder kondensierte. Darüber hinaus wird lediglich die Temperatur im Wasserbad und nicht die des Dampfes gemessen. Durch die Annahme des Normaldrucks und dass Innen- gleich Außendruck ist, kann es ebenfalls zu Abweichungen gekommen sein.
Literatur
[1] W. Glöckner, W. Jansen, R. G. Weissenhorn (Hrsg.), Handbuch der experimentellen Chemie – Sekundarstufe II, Band 9: Kohlenwasserstoffe, Alius Verlag Deubner, 2005, S. 65-67
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.