| Thema: Kunststoffe | Tags: Polykondensation, Nachweisreaktionen | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
Reagenzglas mit Stopfen und 90 ° Glasrohr, Reagenzglas, Stativmaterial, Gasbrenner, evtl. Eisbad
Chemikalien
Citronensäure Monohydrat, D-Sorbit, Kupfersulfat (wasserfrei)
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Citronensäure-1-H2O | H318 | P280-P305+P351+P338-P309+P310 |  |
| Kupfer(II)-sulfat wasserfrei | H302-H319-H315-H410 | -- |   |
| D-Sorbit | Leider in der Datenbank nicht gefunden - bitte nachschlagen! | ||
Durchführung
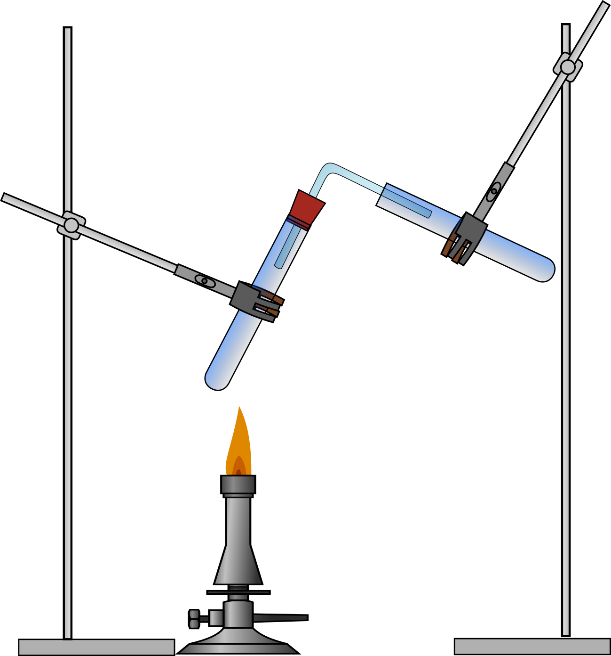
Jeweils 2 Spatellöffel der Citronensäure werden mit dem Sorbit in einem Reagenzglas vermischt. Es wird in einem Stativ eingespannt und mit dem Stopfen, der mit einem 90 ° Glasrohr versehen ist, verschlossen. Das zweite Reagenzglas wird so eingespannt, dass das Glasrohr hineinführt (Abbildung1). Darunter wird bei Bedarf ein Eisbad gestellt. Es kann die Kondensation des entstehenden Wasserdampfes beschleunigen. Das erste Reagenzglas wird sehr vorsichtig mit dem Gasbrenner erhitzt.
Beobachtung
Es entsteht zunächst eine klare Schmelze. Nach einiger Zeit ist eine Gasentwicklung zu sehen. In dem zweiten Reagenzglas schlägt sich eine farblose Flüssigkeit nieder. Die Schmelze wird nach weiterem Erhitzen gelb. Nach dem Auskühlen entsteht ein gelblich-durchsichtiger Feststoff.
Deutung
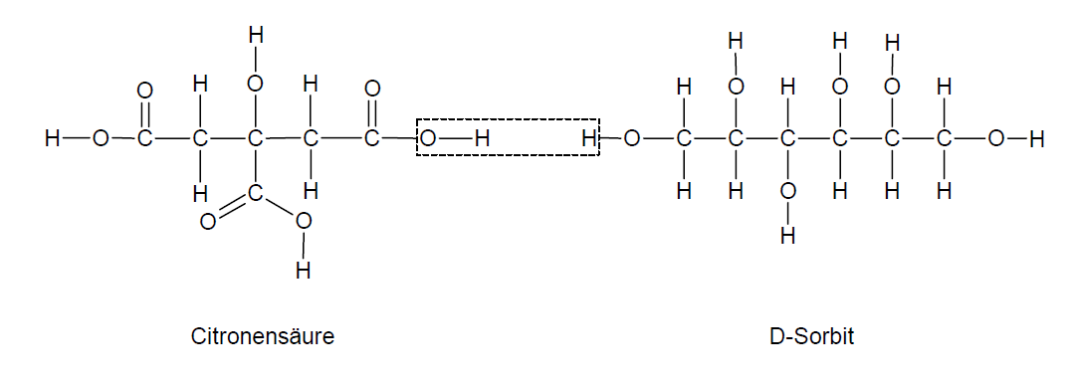
Aus der Reaktion der Edukte entsteht ein dreidimensionaler Polyester. Das zweite Reaktionsprodukt ist Wasser, das mittels Kupfersulfat nachgewiesen werden kann. Obwohl D-Sorbit insgesamt über sechs Hydroxylgruppen verfügt, ist aus sterischen Gründen die Polykondensation an den Kohlenstoffatomen C1 und C6 am wahrscheinlichsten. Die Vernetzung der Makromoleküle kann über die freie Carboxylgruppe der Citronensäure oder über die restlichen Hydroxylgruppen des D-Sorbits und der Citronensäure erfolgen (Abbildung 2).
Entsorgung
Die Entsorgung erfolgt über den Hausmüll.
Literatur
Geuther, A.; Bart.H. Chemische Schulexperimente zu makromolekularen Stoffen. Verfügbar unter: http://fss.plone.uni-giessen.de/fss/fbz/fb08/Inst/Chemiedidaktik /mat/dat/makro.pdf/file/MakroSept06.pdf (Zuletzt abgerufen am 13.08.2015).
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.