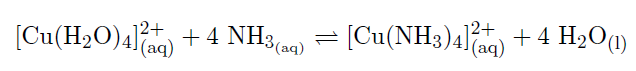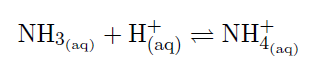| Thema: Chemisches Gleichgewicht | Tags: Komplexgleichgewichte, Prinzip von Le Chatelier, pH-Abhängigkeit, Konzentrationsänderung, Konkurrenzreaktionen, gekoppeltes Gleichgewicht | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
Becherglas (50 mL), Pasteurpipetten, Rührstab, Reagenzgläser
Chemikalien
Kupfer(II)-sulfat Pentahydrat, halbkonzentrierte Schwefelsäure, konzentrierte Ammoniaklösung, Destilliertes Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Kupfer(II)-sulfat-5-H2O | H302-H319-H315-H410 | P280-P273-P302+P352-P305+P351+P338-P309+P311 |   |
| Ammoniaklösung konz. 25% | H314-H400-H335 | -- |    |
| Schwefelsäure 10% | H319-H315 | P280-P302+P352-P305+P351+P338 |  |
Durchführung
Es werden 10 mL einer 0,01 M Kupfersulfat-Lösung (m = 0,025 g) hergestellt und in 3 Reagenzgläser gegeben. In zwei Reagenzgläser wird die Kupfersulfat-Lösung tropfenweise mit konzentrierter Ammoniaklösung versetzt, bis die Lösung eine intensive blaue Färbung zeigt. Danach wird solange halbkonzentrierte Schwefelsäure hinzugegeben, bis diese Färbung verschwunden ist und anschließend erneut konzentrierte Ammoniaklösung hinzu getropft.
Beobachtung
Die hellblaue Kupfersulfatlösung färbt sich bei Zugabe von konzentrierter Ammoniaklösung dunkelblau und es entsteht ein hellblauer Niederschlag. Durch Zugabe von halbkonzentrierter Schwefelsäure entfärbt sich die Lösung. Bei erneuter Zugabe von Ammoniaklösung wird die Lösung wieder dunkelblau.

Deutung
Die hellblaue Farbe ist auf den Tetraaquakupferkomplex zurückzuführen. Beim Hinzugeben der Ammoniaklösung, findet ein Ligandenaustausch statt, wobei vier Wasser-Moleküle durch vier Ammoniak-Moleküle schrittweise ersetzt werden. Es entsteht der sehr stabile Tetraamminkupfer-Komplex (vgl. Abb. 1).
Durch die Zugabe der Schwefelsäure wird die Konzentration der H+-Ionen erhöht, sodass sich das Basengleichgewicht des Ammoniaks (vgl. Abb. 2) auf die Seite des Ammonium-Ions verschiebt. Somit wird die Konzentration des Ammoniaks verringert. Da beide Gleichgewichte miteinander gekoppelt sind, verschiebt sich durch die Konzentrationsabnahme des Ammoniaks das Komplexgleichgewicht auf die Eduktseite, sodass sich der blaue Tetraamminkupfer-Komplex auflöst und sich wieder der Tetraaquakupfer-Komplex bildet. Durch erneute Zugabe von Ammoniak (Edukt) verschiebt sich das Gleichgewicht wieder auf die Seite des Tetraamminkupfer-Komplexes.
Entsorgung
Die Lösungen können im Abfluss entsorgt werden.
Literatur
Nach: D. Wiechoczek, http://www.chemieunterricht.de/dc2/komplexe/aust-gg.html, 06.04.2010 (Zuletzt abgerufen am 12.08.2015 um 12:40Uhr).
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.