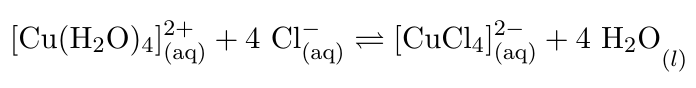| Thema: Chemisches Gleichgewicht | Tags: Komplexgleichgewichte, Prinzip von Le Chatelier, Temperaturänderung, Konzentrationsänderung | Klassenstufen: 11-12 | Versuchsart: SV |
Materialien
Reagenzgläser, Becherglas, Pipette, Kältebad (Eiswasser), Gasbrenner
Chemikalien
Konzentrierte Salzsäure, Kupfer(II)-sulfat-Pentahydrat, Destilliertes Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Kupfer(II)-sulfat-5-H2O | H302-H319-H315-H410 | P280-P273-P302+P352-P305+P351+P338-P309+P311 |   |
| Salzsäure konz. | H314-H335 | -- |   |
Durchführung
a) Es werden ca. 10 mL einer 0,5M Kupfersulfat-Lösung hergestellt und in zwei Reagenzgläser gegeben. Eine Probe dient zum Farbvergleich. Anschließend wird in eines der Reagenzgläser vorsichtig ca. 1-2 mL konzentrierte Salzsäure hinzu getropft (bis zu einer blau-grün Färbung). Danach wird die Lösung mit destilliertem Wasser verdünnt.
b) Die erhaltene verdünnte Lösung aus a) wird mit einem Bunsenbrenner erhitzt und danach vorsichtig im Kältebad wieder abgekühlt.
Beobachtung
a) Die zuvor hellblaue Kupferlösung färbt sich nach der Zugabe von Salzsäure blau-grün. Durch Zugabe von Wasser kehrt die Lösung wieder in die Ursprungsfarbe hellblau zurück.
b) Beim Erhitzen der Lösung stellt sich eine grüne Farbe ein. Nach dem Abkühlen bildet sich die hellblaue Farbe zurück.

Deutung
a) Durch die Zugabe von Edukt im Überschuss (Chlorid-Ionen in Form von Salzsäure) werden alle Wassermoleküle des Tetraaquakupfer(II)-Komplexes verdrängt und das Gleichgewicht verschiebt sich auf die Seite der Produkte. Es bildet sich der grüne Tetrachlorokupfer(II)-Komplex. Es findet also ein Ligandenaustausch statt. Durch die Verdünnung der Lösung wird wieder der Aquakomplex wegen des Überschusses an Wassermolekülen gebildet. Das Gleichgewicht verschiebt sich auf die Seite der Edukte.
b) Die Komplexbildung ist endotherm, da Energie in Form von Wärme in das System gegeben werden muss. Die Steigerung der Temperatur bewirkt eine noch stärkere Verschiebung des Gleichgewichts nach rechts (Bildung von Produkten). Bei der Abkühlung wird das chemische Gleichgewicht auf die Seite der Edukte geschoben.
Entsorgung
Die Lösungen werden in den Schwermetallbehälter gegeben.
Literatur
Nach: D. Wiechoczek, http://www.chemieunterricht.de/dc2/komplexe/aust-gg.html, 12.12.2008 (Zuletzt abgerufen am 12.08.2015 um 13:20Uhr).
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.