| Thema: Enthalpie und Entropie | Tags: kalorimetrisch, Lösungsenthalpie, Lösungswärme | Klassenstufen: 11-12 | Versuchsart: SV |
Materialien
Thermometer, Styroporkalorimeter, Magnetrührer, Becherglas, Rührfisch
Chemikalien
Calciumchlorid (n= 0,1 mol; m= 11,1 g), Calciumchlorid-Hexahydrat(n= 0,1 mol; m= 21,9 g), demineralisiertes Wasser
Durchführung
a) In einem Styroporkalorimeter werden 40 mL demineralisiertes Wasser vorgelegt. Vor Zugabe des Calciumchlorids wird die Temperatur 90 Sekunden lang gemessen. Für 0, 30, 60 und 90 Sekunden wird der Wert notiert. Das Salz wird hinzugegeben und die Temperaturwerte werden alle 30 Sekunden aufgeschrieben. Ändert sich die Temperatur nicht mehr, wird abschließend eine Nachperiode von 1 Minute aufgenommen.
b) Für Calciumchlorid-Hexahydrat wird wie unter a) beschrieben verfahren.
Der Versuchsaufbau ist Abbildung 1 zu entnehmen.
Beobachtung
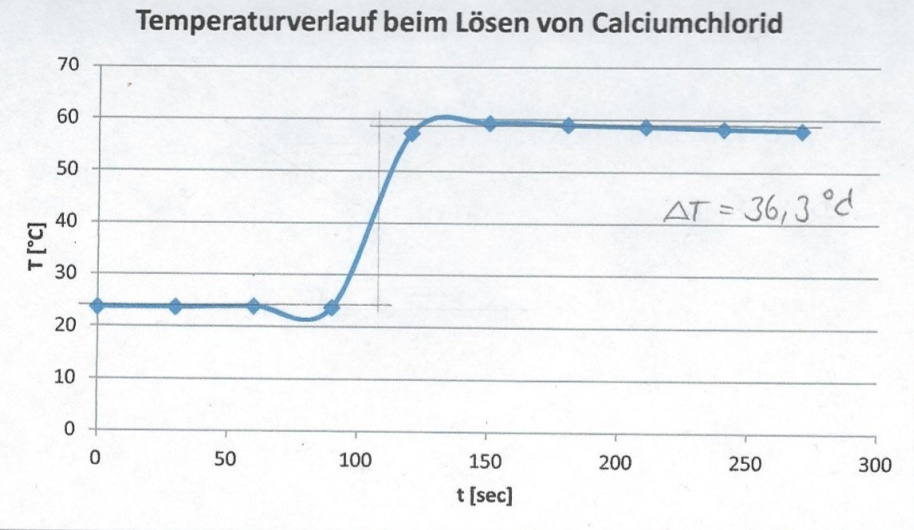
a) Die Starttemperatur liegt bei 23,8 °C. Nach Zugabe des Salzes bei 120 Sekunden steigt sie auf 57,3 °C. Bei 180 Sekunden hat sie einen Wert von 59 °C erreicht, bevor sie in der Nachperiode leicht auf 58 °C sinkt. Bei 270 Sekunden wird die Messung beendet.
| t [sec] | 0 | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 |
|---|---|---|---|---|---|---|---|---|---|---|
| T [°C] | 23,8 | 23,8 | 24 | 23,8 | 57,3 | 59,3 | 59 | 58,7 | 58 | 58 |
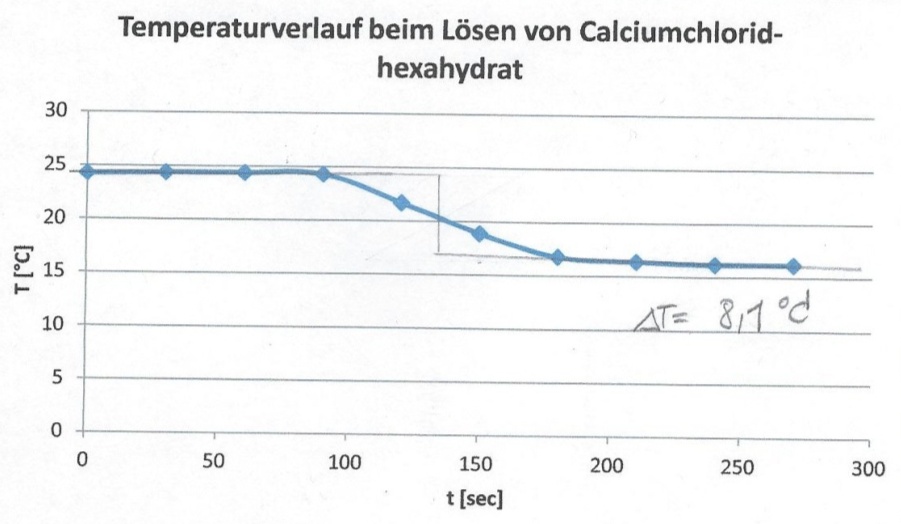
b) Die Starttemperatur liegt bei 24,3 °C. Nach Zugabe des Salzes bei 120 Sekunden sinkt sie zunächst auf 21,7 °C, dann weiter bis 16,2 °C bei 240 Sekunden. Bei 270 Sekunden wird die Messung beendet.
| t [sec] | 0 | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 |
|---|---|---|---|---|---|---|---|---|---|---|
| T [°C] | 24,3 | 24,4 | 24,4 | 24,3 | 21,7 | 18,9 | 16,8 | 16,4 | 16,2 | 16,2 |

Deutung
In einer Auftragung werden die ermittelten Zeit/Temperaturpaare gegeneinander aufgetragen (Abb.2 und Abb.3).
Durch Extrapolation kann ΔT ermittelt werden. Zunächst wird die Wärmemenge Q gesucht.
Diese kann über folgende Formel berechnet werden:
Q = mH2O · cH2O · ΔT
Mit den Werten für die Masse mH2O = 40 g und die Wärmekapazität des WasserscH2O = 4,187 J/(g·K) und der graphisch ermittelten Temperaturdifferenz ΔT = 36,3 °K ergibt sich für die Wärmemenge:
Q = 40 g · 4,187 J/(g·K) · 36,6 K = 6079,52 J
Die molare Lösungsenthalpie ΔHmol für Calciumchlorid liegt folglich bei:
Q/n = 6079,52 J /0,1 mol = 60,8 kJ/mol
Da sich die Lösung erwärmt ist die Lösungsenthalpie negativ:
Q/n = -6079,52 J /0,1 mol = -60,8 kJ/mol
Für b) wird analog vorgegangen, einzig die Temperaturdifferenz ist eine andere: ΔT= 8,1 K.
Q = 40 g · 4,187 J/(g·K) · 8,1 K = 1353,7 J
Q/n = 1353,7 J /0,1 mol = 13,54 kJ/mol
Die Lösungsenthalpie für Calciumchlorid ist negativ, somit hat eine exotherme Reaktion stattgefunden. Im Versuch ist dies an der Erwärmung der Lösung zu erkennen. Da sich die Lösungsenthalpie aus der Gitterenergie und der Hydratationsenthalpie zusammengesetzt, kann nun eine Aussage zu diesen beiden Komponenten getroffen werden. Als Gitterenergie wird jene Energie bezeichnet, die zum Aufbrechen der Kristallstruktur des Calciumchlorids benötigt wird. Die Hydratationsenthalpie wird frei bei der Bildung der Hydrathüllen um die Calcium- und Chloridionen. Je nachdem, welche Energieform überwiegt, nimmt die Lösungsenthalpie entweder einen positiven oder einen negativen Wert an. Im Falle des Calciumchlorids wird durch die Hydratation mehr Energie freigesetzt als für das Aufbrechen der Kristallstruktur benötigt wird. Dass sich die Lösung erwärmt zeigt, dass die Hydratationsenthalpie die Gitterenergie „überkompensiert“.
Anders verhält es sich beim Lösungsvorgang des Calciumchlorid- Hexahydrat. Hierbei nimmt die Lösungsenthalpie einen positiven Wert an und die Lösung kühlt ab. Das lässt sich damit erklären, dass Calciumchlorid-Hexahydrat bereits hydratisiert ist, d.h diese Energie wird nicht mehr frei. Die Energie, die für das Aufbrechen des Gitters nötig ist, wird der Wärmeenergie des Wassers entzogen, sodass eine Abkühlung erfolgt.
Entsorgung
Die gelösten Salze werden über das Abwasser entsorgt. Mit viel Wasser nachspülen.
Der Versuch ist einfach durchzuführen, er ist weder material- noch zeitaufwendig. Die Auswertung hingegen ist nicht trivial, bietet aber viele Anknüpfungspunkte für den weiteren Unterrichtsverlauf. So lässt sich im Anschluss der Born-Haber-Kreisprozess thematisieren, der auf dem Satz von Hess beruht. Da Gitterenergien nicht experimentell bestimmt werden können, wird den SuS an dieser Stelle ein Weg aufgezeigt, Gitterenergien über andere leicht zugänglichere Größen zu ermitteln. Zu nennen sind an dieser Stelle bspw. die Bildungsenthalpie, die Dissoziationsenthalpie und die Sublimationsenthalpie.
Um den Versuch auswerten zu können, sollte den SuS der Begriff der Wärmekapazität und die Lösungsenthalpie, zusammengesetzt aus Gitterenergie und Hydratationsenthalpie bekannt sein. Ist dieses Vorwissen gegeben, zeigt der Versuch verständlich, wie Gitterenergie und Hydratationsenthalpie zusammenspielen.
Eine didaktische Reduktion ist bei der Auswertung möglich. So muss eine Extrapolation nicht zwangsläufig durchgeführt werden. Bei der vorhandenen Datenlage ist eine Temperaturdifferenzbildung aus Anfangstemperatur und Endtemperatur ausreichend.
Literatur
Nordholz, M., Herbst-Irmer, R., Praktikumsskript. Allgemeine und Anorganische Chemie. Georg-August-Universität Göttingen, WS 2011/2012.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.