| Thema: Carbonsäuren, Ester und Ether | Tags: Ester, Hydrolyse, alkalisch | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
Reagenzglasständer, 3 Reagenzgläser, Stopfen, Pasteurpipetten
Chemikalien
Essigsäureethylester, Phenolphthalein (w = 0,1%), Natronlauge, Natriumacetat, Eisen(III)-chlorid,
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Ethanol | 225‐319 | 210‐240‐305+351+338‐403+233 |   |
| Essigsäure | H314 | P280-P301+P330+P331-P305+P351+P338-P309+P310 |  |
| Natriumacetat-3-H2O | -- | -- | |
| Essigsäureethylester | H225-H319-H336-EUH066 | -- |   |
| Natronlauge 1 M | H314 | P280-P301+P330+P331-P305+P351+P338-P309+P310 |  |
| Phenolphthaleinlösung < 1% in Ethanol-Wasser 1:1 | H226 | -- |  |
| Eisen(III)-chlorid-6-H2O | H290-H302-H315-H318 | P280-P305+P351+P338 |   |
Durchführung
Die drei Reagenzgläser werden nach folgendem Schema befüllt:
| Reagenzglas 1 | Reagenzglas 2 | Reagenzglas 3 |
2 mL Eisenchlorid-Lösung 2 mL Natriumacetat-Lösung | 2 mL Essigsäureethylester 2 mL Eisenchlorid-Lösung | 2 mL Essigsäureethylester 4 mL destilliertes Wasser 4 Tropfen Phenolphtalein-Lösung einige Tropfen Natronlauge |
Reagenzglas 3 wird anschließend mit einem Stopfen verschlossen und solange geschüttelt, bis die rosa Färbung verschwunden ist. Anschließend wird ca. 1 mL Eisenchlorid-Lösung in das Reagenzglas gegeben.
Beobachtung
| Reagenzglas 1: | Nach Zugabe der Eisenchlorid-Lösung ist eine orange- braune Färbung zu sehen. |
Reagenzglas 2:
| Nach Zugabe der Eisenchlorid-Lösung bilden sich zwei Phasen im Reagenzglas. Die untere Phase ist gelb gefärbt. |
Reagenzglas 3:
| Nach Zugabe der Natronlauge färbt sich die Lösung rosa. Durch das schütteln wird die Lösung wieder entfärbt. Nach Zugabe von Eisenchlorid-Lösung ist eine orange-braune Färbung zu erkennen. |
Deutung
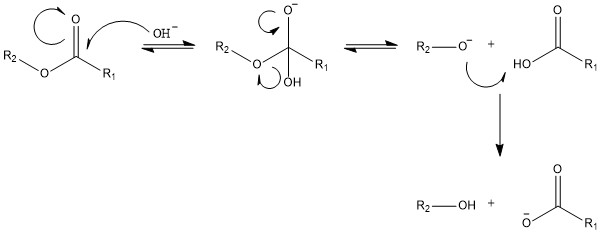
In Reagenzglas 3 findet eine alkalische Esterhydrolyse nach dem Mechanismus aus Abbildung 2 statt.
Die rosa Färbung ist durch den Indikator Phenolphthalein zu erklären. Nach Zugabe der Natronlauge wird die Lösung alkalisch, was einen Farbumschlag des Indikators zur Folge hat. Die Natronlauge wird allerdings in der Reaktion umgesetzt, wodurch der Farbumschlag wieder verschwindet. Eisenchlorid dient hierbei als Nachweis für Acetat-Ionen. Die Eisenionen bilden mit den Acetationen einen orange-braunen Eisenacetat-Komplex. Reagenzglas 1 dient als positiv Blindprobe in diesem Experiment und Reagenzglas 2 als negativ Blindprobe, um zu zeigen, dass der Acetat-Nachweis erst nach der Hydrolyse des Esters positiv ist.
Entsorgung
Die Lösungen werden im Schwermetallbehälter entsorgt.
Literatur
E. Irmer, R. Kleinhenn, et. al, Elemente Chemie 11/12, Klett-Verlag, Stuttgart, 2010, S.52.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.