| Thema: Enthalpie und Entropie | Tags: Entropie, molare Reaktionsenthalpie | Klassenstufen: 11-12 | Versuchsart: SV |
Materialien
Styroporkalorimeter, Magnetrührer, Digitalthermometer, Stativ, Spatel
Chemikalien
Kupfersulfat-Pentahydrat, Zink-Pulver, Zinksulfat-Heptahydrat, Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Kupfer(II)-sulfat-5-H2O | H302-H319-H315-H410 | P280-P273-P302+P352-P305+P351+P338-P309+P311 |   |
| Zink Pulver | H410 | -- |  |
| Zinksulfat-7-H2O | H302-H318-H410 | -- |    |
Durchführung
In einem Styroporkalorimeter werden zu 100 mL einer 0,1 molaren Kupfersulfat-Lösung schnell 6,5 g Zink-Pulver hinzugegeben. Dabei wird die Temperaturentwicklung verfolgt (mit Vor- und Nachperiode).
Beobachtung
Nach Zugabe des Zinks verfärbt sich die Lösung von hellblau zu grauschwarz. Es bildet sich ein grauer Feststoff in der Lösung.
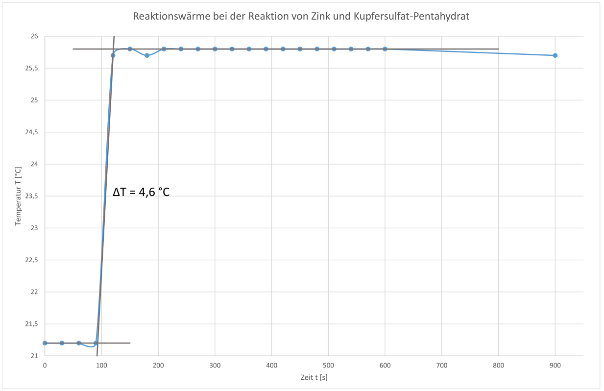
Vorperiode 0-90 s / Zugabe des Zinks ab 120 s
| Zeit t [s] |
0 | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 | 300 | 330 | 360 | 390 | 420 | 450 | 480 | 510 | 540 | 570 | 600 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Temperatur T [°C] |
21,2 | 21,2 | 21,2 | 21,2 | 25,7 | 25,8 | 25,7 | 25,8 | 25,8 | 25,8 |
25,8 | 25,8 | 25,8 | 25,8 | 25,8 | 25,8 | 25,8 | 25,8 | 25,8 | 25,8 | 25,8 |
Nachperiode: nach 15 Minuten → 25,7 °C
Deutung
Es läuft eine Redoxreaktion ab.
| Reduktion: | Cu2+ + 2 e- → Cu |
| Oxidation: | Zn → Zn2+ + 2 e- |
| Gesamtreaktion: | Cu2+(aq) + Zn(s) → Cu(s) + Zn2+(aq) |
Aus der Auftragung lassen sich folgender Wert bestimmen:
ΔT = 4,6 °C = 4,6 K
Damit lässt sich die Reaktionswärme Q folgendermaßen berechnen:
Q = -cp (Wasser) · m(Wasser) · ΔT
wobei cp (Wasser) die spezifische Wärmekapazität des Wassers ist. In wässrigen Lösungen ist der Wert der spezifischen Wärmekapazität gleich dem des Wassers. Also gilt:
Q = -4,187 J/g · K · 100 g · 4,6 K = -1926,02 J = -1,926 kJ
Das reagierende System verliert bei dieser exothermen Reaktion also Energie. Dementsprechend gilt für die Änderung der Inneren Energie ΔU = Q. Wird der Druck während einer Reaktion konstant gehalten, so bezeichnet man die gemessene Reaktionswärme als Reaktionsenthalpie ΔH. Für den Zusammenhang zwischen Reaktionsenthalpie und Innerer Energie gilt:
ΔH = ΔU + p · ΔV
Dabei ist p der Druck und ΔV die Volumenänderung, welche zusammen als Volumenarbeit WV = p · ΔV bezeichnet werden. Bei konstantem Volumen ergibt sich also ΔH = ΔU.
Damit folgt, dass ΔrH = -1,926 kJ.
Die molare Reaktionsenthalpie errechnet sich über die eingesetzte Stoffmenge an Kupfersulfat-Lösung:
| ΔrHm = |
| = -192,6 kJ/mol |
Vergleich mit dem Literaturwert: ΔrHm = -218,66 kJ/mol
Fehlerrechnung:
xabsolut = | -192,6 kJ/mol - (-218,66 kJ/mol) | = 26,06 kJ/mol
| xrelativ = | | |
| | | · 100 % | = 13,53 % |
Entsorgung
Die Entsorgung erfolgt über den Abfluss und unter kräftigem Nachspülen mit Wasser.
Literatur
[1] Universität Göttingen, Praktikumsskript zum Anorganisch-Chemischen Praktikum für Lehramtskandidaten, 2013, S. 68.
[2] P.W. Atkins, Kurzlehrbuch Physikalische Chemie, WILEY-VCH, 4. Auflage, 2008, S. 1084/1086.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.