| Thema: Enthalpie und Entropie | Tags: Lösungswärme, molare Reaktionsenthalpie | Klassenstufen: 11-12 | Versuchsart: SV |
Materialien
Styroporkalorimeter, Magnetrührer, Digitalthermometer, Stativ, Spatel
Chemikalien
Calciumchlorid, Calciumchlorid-Hexahydrat, Wasser
Durchführung
In einem Styroporkalorimeter werden in 40 mL Wasser je 0,1 mol Calciumchlorid bzw. Calciumchlorid-Hexahydrat gelöst. Über 10 Minuten wird die Temperatur alle 30 Sekunden notiert. Eine Vor- und Nachperiode sind aufzunehmen.
Beobachtung
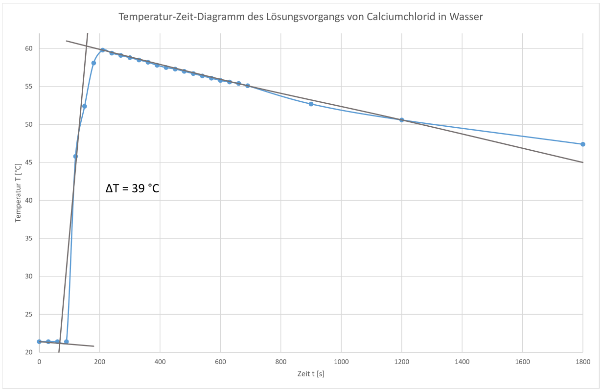
Die Zugabe der Salze erfolgte nach einer Vorperiode von 2 Minuten jeweils ab 120 Sekunden. Der Versuch liefert nach der Zugabe von Calciumchlorid die folgenden Werte:
| Zeit t [s] |
0 | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 |
300 | 330 | 360 | 390 | 420 |
450 | 480 | 510 | 540 | 570 | 600 | 630 | 660 | 690 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Temperatur T [°C] |
21,4 |
21,4 |
21,4 |
21,4 |
45,8 |
52,4 |
58,1 |
59,8 |
59,4 |
59,1 |
58,8 |
58,5 |
58,2 |
57,8 |
57,5 | 57,3 |
57,0 |
56,7 |
56,4 |
56,1 |
55,8 |
55,6 |
55,4 |
55,1 |
Nachperiode:
- nach 15 Minuten → 52,7 °C
- nach 20 Minuten → 50,6 °C
- nach 30 Minuten → 47,4 °C
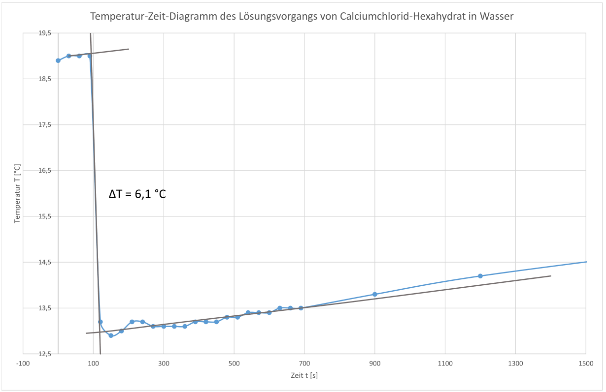
Der Versuch liefert bei der Zugabe von Calciumchlorid-Hexahydrat folgende Werte:
| Zeit t [s] |
0 | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 |
300 | 330 | 360 | 390 | 420 |
450 | 480 | 510 | 540 | 570 | 600 | 630 | 660 | 690 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Temperatur T [°C] |
18,9 | 19,0 | 19,0 |
19,0 | 13,2 | 12,9 | 13,0 | 13,2 | 13,2 | 13,1 | 13,1 | 13,1 | 13,1 | 13,2 | 13,2 | 13,2 |
13,3 | 13,3 | 13,4 | 13,4 | 13,4 | 13,5 | 13,5 |
13,5 |
Nachperiode:
- nach 15 Minuten → 13,8 °C
- nach 20 Minuten → 14,2 °C
- nach 30 Minuten → 14,8 °C
Deutung
Berechnung der Lösungsenthalpie (Calciumchlorid):
ΔrH = -4,187 J/g · K · 40 g · 39 K = -6531,72 J = -6,532 kJ
| ΔrHm = |
| = −65,32 kJ/mol |
Berechnung der Lösungsenthalpie (Calciumchlorid-Hexahydrat):
ΔrH = -4,187 J/g · K · 40 g · (-6,1 K) = 1021,63 J = 1,022 kJ
| ΔrHm = |
| = 10,22 kJ/mol |
Demzufolge verläuft das Lösen von Calciumchlorid exotherm (ΔH < 0), bei Calciumchlorid-Hexahydrat endotherm (ΔH > 0). Das unterschiedliche Verhalten der beiden Salze begründet sich durch das Kristallwasser. Um das Calciumchlorid-Gitter aufzulösen, muss erst die Gitterenergie aufgewendet werden, um den energetisch günstigen Zustand zu zerstören. Die anschließende Hydratisierung der frei gewordenen Ionen setzt jedoch so viel Energie frei, sodass der Betrag der Hydratationsenthalpie größer als der der Gitterenergie ist. Damit begründet sich das exotherme Verhalten.
Bei Calciumchlorid-Hexahydrat ist die aufzuwendende Gitterenergie dieselbe, allerdings sind die Ionen durch das Kristallwasser vorab schon hydratisiert. Daher können die Wassermoleküle der Kalorimeter-Flüssigkeit sich nicht mehr in dem Maße anlagern, wie es bei Calciumchlorid der Fall ist. Deshalb wird auch nicht so viel Energie frei wie bei Calciumchlorid bzw. der Betrag der Gitterenergie ist größer als die Hydratationsenthalpie, sodass ΔH > 0, also die Reaktion endotherm ist.
Vergleich mit den Literaturwerten [2]:
ΔrHm(CaCl2) = 14 kJ/mol
xabs = | −65,32 kJ/mol − (−83 kJ/mol) | = 17,68 kJ/mol
| xrel = | | |
| | · 100% | = 27,07 % |
ΔrHm(CaCl2 · 6 H2O) = −83 kJ/mol
xabs = | 10,22 kJ/mol − 14 kJ/mol | = 3,78 kJ/mol
| xrel = | | |
| | · 100% | = 36,99 % |
Entsorgung
Die Entsorgung der gelösten Salze erfolgt über das Abwasser mit viel nachspülen von Wasser.
Literatur
[1] Universität Göttingen, Praktikumsskript zum Anorganisch-Chemischen Praktikum für Lehramtskandidaten, 2013, S. 32-33.
[2] E. Riedel, Anorganische Chemie, 4. Auflage, 1999, Berlin, S. 591.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.