| Thema: Stickstoff II | Tags: Stickstoff in Luft, Redoxreaktion, Stickstoffreaktion | Klassenstufen: 7-8 | Versuchsart: LV |
Materialien
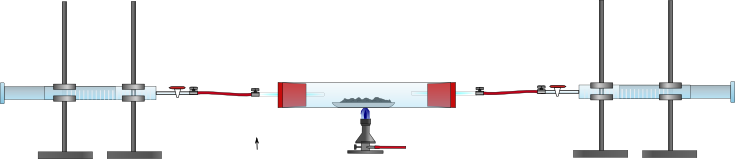
2 Kolbenprober, Verbrennungsrohr, durchbohrte Gummistopfen mit Glasrohr, Drei-Wege-Hahn, Schlauchverbindungen, Porzellanschiffchen, Bunsenbrenner
Optional: Reagenzglas, Universalindikatorpapier
Chemikalien
Magnesiumpulver, Luft
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Magnesium | H228-H261-H252 | -- |  |
Durchführung
Die Versuchsapparatur wird wie in der unten aufgeführten Skizze aufgebaut. 1 g Magnesiumpulver wird abgewogen und auf dem Porzellanschiffchen in das Verbrennungsrohr geschoben. Mit Hilfe des Drei-Wege-Hahns werden in einen Kolbenprober 50 mL Luft gesaugt. Anschließend wird der Drei-Wege-Hahn so eingestellt, dass der Durchgang zum Verbrennungsrohr offen ist. Mit rauschender Bunsenbrennerflamme wird das Magnesium erhitzt, währenddessen wird einige Male langsam Luft über das Magnesium geleitet (mit den Kolbenprobern), bis die Reaktion vollständig abgelaufen ist. Nach dem Abkühlen der Apparatur wird das Gasvolumen in der Apparatur am Kolbenprober abgelesen.
Optional: Ein Teil des Reaktionsproduktes wird in ein Reagenzglas gegeben, mit einigen Tropfen Wasser versetzt und mit dem feuchten Universalindikator getestet. Abschließend ist eine Geruchsprobe durchzuführen.
Beobachtung
Zuerst schiebt sich der Kolbenprober auf ein Volumen von etwa 60 mL heraus, dann leuchtet das Magnesiumpulver hell auf, wenn die Luft darüber geleitet wird. Das Volumen nach dem Abkühlen beträgt etwa 45 mL. Das Produkt ist in der Mitte grau-weiß, an den Rändern grünlich-grau.
Optional: Das Produkt löst sich in Wasser, es entstehen Bläschen. Bei der Geruchsprobe wird ein Ammoniakgeruch festgestellt und das feuchte Universalindikatorpapier färbt sich blau.
Deutung
Es haben circa 15 mL Luft mit dem Magnesium reagiert. Die Volumenabnahme ist größer als der Sauerstoffanteil in der Luft, es hat also neben Sauerstoff auch Stickstoff mit dem Magnesium reagiert. Deswegen hat das Reaktionsprodukt auch zwei Farben: Bei dem weißen Produkt handelt es sich um Magnesiumoxid, beim grünlich-grauen Produkt um Magnesiumnitrid.
| Magnesium + Sauerstoff → Magnesiumoxid | 2 Mg (s) + O2 (g) → 2 MgO (s) |
| Magnesium + Stickstoff → Magnesiumnitrid | 3 Mg (s) + N2 → Mg3N2 (s) |
Optional: Beim Lösen des Produktes reagiert das Magnesiumnitrid zu Ammoniak und Magnesiumoxid. Ammoniak reagiert bei Kontakt mit Wasser basisch, wodurch das Universalindikatorpapier blau gefärbt wird.
Entsorgung
Die Reste werden mit Wasser versetzt und über das Abwasser entsorgt. Feststoffe kommen in den Hausmüll.
Literatur
H. Boeck, H. Keune, Chemische Schulexpermente Band 1: Anorganische Chemie, Cornelsen, 1. Auflage, 2. Druck, 2009, S. 126.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.