| Thema: Klassischer Redoxbegriff III | Tags: Nichtmetalle, Magnesium, Reduktion | Klassenstufen: 7-8 | Versuchsart: LV |
Materialien
Reagenzglas, Lochstopfen, Flammenfalle, Spatellöffel, Pipette, Magnesiarinne, Tiegelzange, Stativmaterial, Gasbrenner.
Chemikalien
Wasser, Seesand, Magnesium
Durchführung
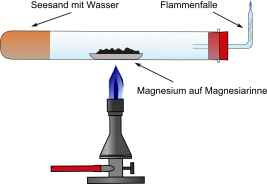
Das Reagenzglas wird mit 4 cm Sand befüllt. Mittels einer Pipette wird der Sand vorsichtig angefeuchtet. Dabei ist darauf zu achten, dass die Glaswand nicht nass wird. Anschließend wird das Reagenzglas horizontal in ein Stativ eingespannt. Eine Magnesiarinne wird mit Magnesium befüllt, welche vor dem Sand in das Reagenzglas gestellt wird. Schließlich wird das Reagenzglas mit einem Lochstopfen samt Flammenfalle verschlossen.
Die Magnesiarinne wird von außen mit dem Gasbrenner solange erhitzt, bis das Magnesium anfängt aufzuglühen. Anschließend wird vorsichtig der Seesand erhitzt, wobei von der Mitte in Richtung des Reagenzglasbodens gearbeitet wird. Das entstehende Gas wird an der Flammenfalle entzündet.
Beobachtung
Wird der Sand erhitzt, beginnt das Magnesium stark an zu glühen. Es entweicht ein Gas aus der Flammenfalle, dass mit orangener Flamme brennt. Nach Beendigung der Reaktion liegt ein weißer, poröser Feststoff in der Magnesiarinne vor.
Deutung
Wird der feuchte Sand erhitzt nachdem das Magnesium angefangen hat zu glühen, so entsteht Wasserdampf. Dieser oxidiert das Magnesium zu Magnesiumoxid, während er gleichzeitig zu Wasserstoff reduziert wird. Der entstandene Wasserstoff tritt schließlich aus der Flammenfalle aus und brennt nach dem Entzünden mit orangener Flamme.
Magnesium (s) + Wasser (g) → Magnesiumoxid (s) + Wasserstoff (g)
Mg (s) + H2O (g) → MgO (s) + H2 (g)
Entsorgung
erfolgt über den Hausmüll.
Literatur
Institut für Didaktik der Chemie, Justus-Liebig-Universität Giessen, http://www.uni-giessen.de/cms/fbz/fb08/Inst/Chemiedidaktik/mat/dat/ Did1Sk, 22.03.2013 (Zuletzt abgerufen am 13.08.2014 um 20:34).
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.