Ziel des Versuchs: In diesem Versuch wird die Abhängigkeit der Massenzunahme bei steigenden Volumen von Wasser, Ethanol, Apfelsaft und Speiseöl untersucht.
Materialien
4 Bechergläser (200 mL), Speiseöl, Apfelsaft, Wasser, Waage, Messzylinder
Durchführung
Vor Beginn wird die Masse jedes der Bechergläser bestimmt. In jedes der Bechergläser werden je 10 mL der verschiedenen Flüssigkeiten mithilfe des Messzylinders abgefüllt. Danach wird die Masse gemessen. Anschließend wird ebenso bei 20 mL, 30 mL, 50 mL und 100 mL verfahren. Im Anschluss wird die jeweilige Masse gegen die einzelnen Volumina aufgetragen
Beobachtung
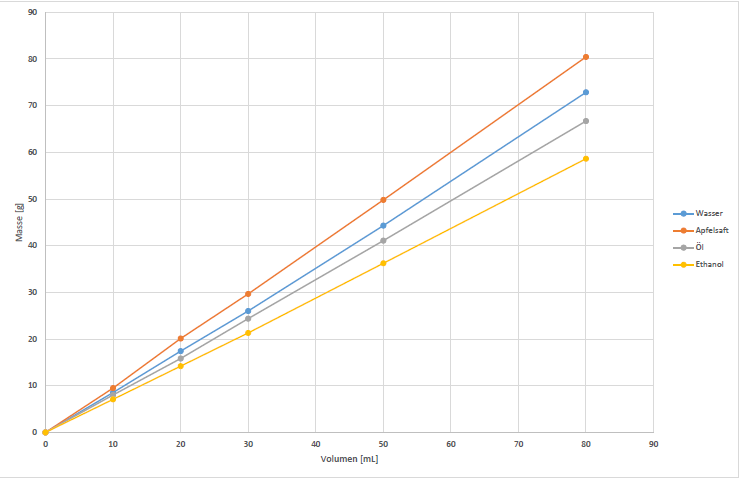
Die Masse der Flüssigkeiten nimmt proportional zum Volumen zu.
Deutung
Sowohl bei der Masse als auch bei dem Volumen handelt es sich nicht um Stoffeigenschaften. Allerdings ist der Quotient aus Masse und Volumen, die sogenannte Dichte, eine Stoffeigenschaft. Der Quotient bleibt bei jedem Volumen gleich. Die Auftragung zeigt, dass Apfelsaft die höchste und Ethanol die geringste Dichte hat. Beim Vergleich mit den Literaturwerten ergeben sich relative Fehler von weniger als 15 %.
| Apfelsaft: | y = 1,0065x – 0,2884 ⇒ | ρ = 1,0065 g/cm3 |
| | Literaturwert: | ρ = 1,035 g/cm3 [1] |
| absoluter Fehler | Δabs = | | x - xLit | | | = | | 1,0065−1,035 | g/cm3 | | = | 0,0285 g/cm3 |
| |
| relativer Fehler | Δrel = | | · 100 % | = | | · 100 % |
= | 2,75 % |
| Wasser: | y = 0,911x – 0,6621 ⇒ | ρ = 0,911 g/cm3 |
| | Literaturwert: | ρ = 1,000 g/cm3 [2] |
| absoluter Fehler | Δabs = | | x - xLit | | | = | | 1,000−0,911 | g/cm3 | | = | 0,089 g/cm3 |
| |
| relativer Fehler | Δrel = | | · 100 % | = | | · 100 % |
= | 8,90 % |
| Öl: | y = 0,8355x-0,4576 ⇒ | ρ =0,8355 g/cm3 |
| | Literaturwert: | ρ = 0,92 g/cm3 [3] |
| absoluter Fehler | Δabs = | | x - xLit | | | = | | 0,8355−0,92 | g/cm3 | | = | 0,0845 g/cm3 |
| |
| relativer Fehler | Δrel = | | · 100 % | = | | · 100 % |
= | 9,19 % |
| Ethanol: | y = 0,7339x-0,3327 ⇒ | ρ =0,7339 g/cm3 |
| | Literaturwert: | ρ = 0,789 g/cm3 [4] |
| absoluter Fehler | Δabs = | | x - xLit | | | = | | 0,7339−0,789 | g/cm3 | | = | 0,0551 g/cm3 |
| |
| relativer Fehler | Δrel = | | · 100 % | = | | · 100 % |
= | 6,98 % |
Entsorgung
erfolgt über den Abfluss.
Anmerkungen & Unterrichtsanschlüsse: Der Versuch bietet eine gute Möglichkeit für die Einführung des Dichtebegriffs.
Literatur
[1] W. Eisner, P. Gietz, elemente chemie I, Klett, 2. Auflage, 2007, S. 20
[2] http://www.onlinemathe.de/forum/Alkoholgehalt-anhand-der-Dichte-berechnen, 19.06.2004 (zuletzt aufgerufen am 29.07.2016)
[3] https://de.wikipedia.org/wiki/Wasser, (zuletzt aufgerufen am 29.07.2016)[7] http://www.3a-wassertechnik.de/uploads/media/Dichtetabelle_Fettabscheideranlagen.pdf, 06.2014 (zuletzt aufgerufen am 29.07.2016)
[4] https://de.wikipedia.org/wiki/Ethanol, (zuletzt aufgerufen am 29.07.2016)