| Thema: Erweiterter Redoxbegriff | Tags: Erweiterter Redoxbegriff, Batterie | Klassenstufen: 7-8 | Versuchsart: SV |
Materialien
2 Bechergläser (250 mL), Zinkelektrode, Kupferelektrode, Multimeter, Kabelverbindungen, Filterpapierstreifen
Chemikalien
Zinksulfat-Heptahydrat, Kupfersulfat-Pentahydrat, Kaliumnitrat, Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Zinksulfat-7-H2O | H302-H318-H410 | -- |    |
| Kupfer(II)-sulfat-5-H2O | H302-H319-H315-H410 | P280-P273-P302+P352-P305+P351+P338-P309+P311 |   |
| Kaliumnitrat | H272 | P220 |  |
| Kupfer | -- | -- | |
| Zink gekörnt | H260-H250-H410 | -- |   |
Durchführung
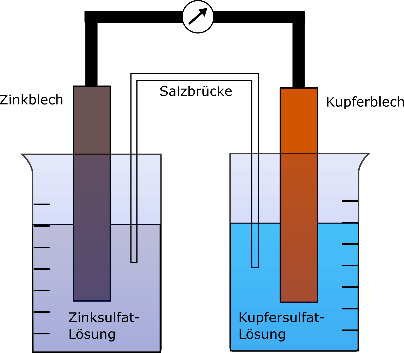
Es werden 0,1 M Kupfersulfat- und Zinksulfat-Lösungen zu je 100 mL angesetzt. In einer 1 M Kaliumnitrat-Lösung wird ein Filterpapierstreifen getränkt, welcher im Folgenden als Salzbrücke dient. Der weitere Aufbau entspricht der untenstehenden
Beobachtung
Nach Einstellen des Gleichstroms wird am Multimeter eine Spannung von 1,097 V gemessen.
Deutung
Die Salzbrücke generiert den Ionen- und Elektronenfluss zwischen den beiden Halbzellen. Ohne sie wäre der Stromkreis nicht geschlossen und es wäre keine Potentialdifferenz messbar.
Es verläuft eine Redoxreaktion, wobei die Zinkelektrode als Reduktionsmittel dient und folglich oxidiert wird. Als Oxidationsmittel fungiert in diesem Fall die Kupfersulfat-Lösung, wobei die Kupferionen reduziert werden.
Reduktion: Cu2+ + 2e− → Cu
Oxidation: Zn → Zn2+ + 2e−
Gesamtgleichung: Cu2+(aq) + Zn(s) → Zn2+(aq) + Cu(s)
Entsorgung
Die Lösungen werden im Schwermetallbehälter entsorgt.
Alternativ können andere Halbzellen verwendet werden, damit eine Verallgemeinerung vorgenommen werden kann.
Da der Themenblock Elektrochemie erst in der Oberstufe vorgesehen ist, sollten didaktische Reduktionen in Hinblick auf das Galvanische Element allgemein vorgenommen werden. Zum einen muss nicht tiefgehender thematisiert werden, dass der Versuch das Funktionsprinzip einer Batterie darstellt, zum anderen sollten Plus- und Minuspol in Form der Elektroden (also Beschreibung als Anode und Kathode) unberücksichtigt bleiben und vielmehr der Blick auf die redoxchemischen Vorgänge gelegt werden.Literatur
[4] Uni Göttingen, Praktikumsskript zum Anorganisch-Chemischen Praktikum für Lehramtskandidaten, 2013, S. 72.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.