| Thema: Alkoholgehaltsbestimmung und Alkoholherstellung | Tags: Destillation, Alkoholgehalt, Bestimmung, Pyknometrie | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
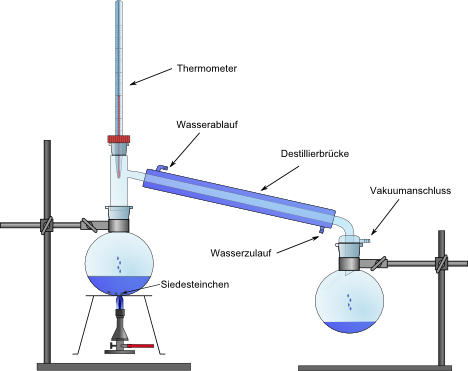
zwei Rundkolben (100 mL), Hexe, Heizplatte, Ölbad, Destillationsbrücke, Thermometer, Wasserschläuche, Messzylinder (50 mL), Waage, Siedesteine
Chemikalien
verschiedene alkoholische Getränke
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Ethanol | 225‐319 | 210‐240‐305+351+338‐403+233 |   |
Durchführung
Die Destillationsapparatur wird wie in der Abbildung aufgebaut. Der rechte Rundkolben wird vor der Destillation gewogen. In den linken werden einige Siedesteine sowie 50 mL des zu untersuchenden alkoholischen Getränks gegeben. Die Kolben werden an der Apparatur befestigt und der linke Kolben mit dem Ölbad langsam erhitzt, bis die Lösung zu sieden beginnt und einige Tropfen in den rechten Kolben fallen. Hier wird die Temperatur abgelesen.
Wenn die Tropfen aufhören zu fallen, wird das Ölbad entfernt und die Apparatur kurz zum Abkühlen stehen gelassen. Der rechte Kolben wird nun erneut gewogen. Zudem wird das Volumen des Destillats bestimmt und die Dichte berechnet.
Beobachtung
Die Lösung beginnt bei ca. 80 °C zu sieden. Der aufsteigende Dampf kondensiert in der Destillationsbrücke und fällt in den rechten Kolben.
Deutung
Anhand einer Dichtekurve wird der Volumengehalt an Ethanol bestimmt und daraus der tatsächliche Gehalt an Ethanol im Destillat bestimmt. Dieser wird nun durch das Volumen an Ausgangslösung geteilt, um den Alkoholgehalt der Lösung zu bestimmen.
Kräuterschnaps „Mümmelmann“
Massendifferenz: 12,9 g, Volumen: 26 mL, Dichte: 0,49 g/mL
→ Ethanolgehalt des Destillats: 100%, Alkoholgehalt: 52%, Etikett: 35%
Wein „Ciao“
Massendifferenz: 5,3 g, Volumen: 8 mL, Dichte: 0,6 g/mL
→ Ethanolgehalt des Destillats: 100%, Alkoholgehalt: 16%, Etikett: 9,2%
Bier „Beck‘s“
Massendifferenz: 6 g, Volumen: 9 mL, Dichte: 0,66 g/mL
→ Ethanolgehalt des Destillats: 100%, Alkoholgehalt: 18%, Etikett: 4,9%
Entsorgung
Die Lösungen können in den Abfluss gegeben werden.
Die Gründe für die Fehler, die in diesem Versuch auftreten, lassen sich gut mit den SuS auswerten. Insbesondere die Dichte des Ethanols, die niedriger ist als die einer 100%- Ethanollösung ist, deutet drauf hin, dass Stoffe in den Getränken vorliegen, die eine geringere Dichte als Ethanol und auch einen niedrigeren Siedepunkt haben. Dadurch wird die Auswertung verfälscht. Zudem wurde bei der Durchführung immer nur bis ca. 98 °C erhitzt, wodurch kaum Wasser in das Destillat gelangt sein sollte; eventuell wäre für die SuS eine Destillation darüber hinaus sinnvoll, um die Dichtekurve des Ethanol auch wirklich anwenden zu können.
Im Unterricht kann die Destillation in Gruppen durchgeführt werden, die jeweils unterschiedliche alkoholische Getränke untersuchen. Dafür sollte jedoch eine Doppelstunde genutzt werden, da die Destillation recht lange dauert. Zudem sollten Aufgaben für die Wartezeit bei der Destillation gestellt werden. Bei der Destillation von Bier sollte etwas Gerbsäure hinzugegeben werden, um das Aufschäumen des Bieres zu verringern.
Literatur
Asselborn W. u.a. (Hrsg.), Chemie heute- Sekundarstufe II, Schroedel Verlag 2006, S.251.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.