| Thema: Von Arrhenius zu Brönstedt II | Tags: Neutralisation, Natronlauge, Salzsäure | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
Magnetrührer, Rührfisch, 3x 100 ml Becherglas, 250 ml Becherglas, Messpipette, Messzylinder, Spatel
Chemikalien
0,1 M Salzsäure, 0,1 M Natronlauge, Universalindikator, Kaliumdihydrogenphosphat, Dinatriumhydrogenphosphat, dest. Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Salzsäure 0,1 M | H290 | -- |  |
| Natronlauge 0,1 M | H314 | P280-P305+P351+P338-P310 |  |
| Universalindikator 0-14 | -- | -- | |
| Kaliumdihydrogenphosphat | -- | -- | |
| Dinatriumdihydrogendiphosphat | H319 | P305+P351+P338 |  |
Durchführung
Es werden jeweils 20 ml 0,1 M Salzsäure und 20 ml 0,1 M Natronlauge mithilfe der Messpipette und des Messzylinders abgemessen und jeweils in ein 100 ml Becherglas gegeben. Anschließend wird Universalindikator hinzugegeben. Die Pufferlösung wird mit 3,52 g Kaliumdihydrogenphosphat, 7,26 g Dinatriumhydrogenphosphat und 100 ml dest. Wasser hergestellt. Davon werden 2 ml in die Salzsäurelösung und die Natronlaugenlösung gegeben. Die beiden Lösungen werden in ein Becherglas gegeben, welches auf dem Magnetrührer mit Rührfisch steht.
Beobachtung
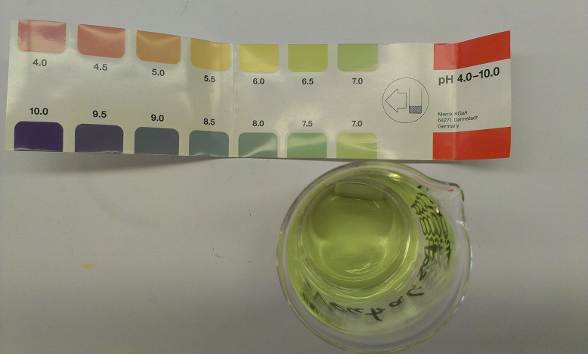
Bei Zugabe von Universalindikator färbt sich die Salzsäure pink und die Natronlauge lila. Nach der Neutralisation liegt eine grüne Lösung vor.
Deutung
Im ersten Teil des Versuchs dissoziieren die Natronlauge und die Salzsäure in ihre Ionen, so dass bei der Natronlauge die OH- - Ionen und bei der Salzsäure die H+-Ionen mit dem Indikator nachgewiesen werden. Dies lässt sich noch mit dem Arrhenius-Konzept erklären. Die nachfolgende Neutralisation wird hingegen mit dem Brönstedt-Konzept bewiesen.
Die Hydroxidionen der Natronlauge reagieren mit den Wasserstoffionen der Salzsäure zu Wasser. Da Salzsäure und Natronlauge vollständig dissoziieren und gleiche Stoffmengen verwendet wurden, liegt die gleiche Anzahl an H+ - und OH- - Ionen vor. Daher ist die Lösung anschließend neutral.
Na+(aq) + OH-(aq) + H+(aq) + Cl-(aq) → H2O(l) + Na+(aq) + Cl-(aq)
Entsorgung
Die neutralisierte Lösung kann in den Abfluss entsorgt werden.
Literatur
Häusler, K. et al.(1995): Experimente für den Chemieunterricht, München: Oldenbourg, S. 119 f.Seilnacht, T. (o.A.): Neutralisation, abrufbar unter: http://www.seilnacht. com/Lexikon/Neutrali.html, eingesehen am 14.8.2014.
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.